题目内容
【题目】在20mL某硫酸铜溶液中,逐滴加入某浓度的氢氧化钡溶液,溶液的pH值随加入的Ba(OH)2溶液体积的变化曲线如图甲所示:
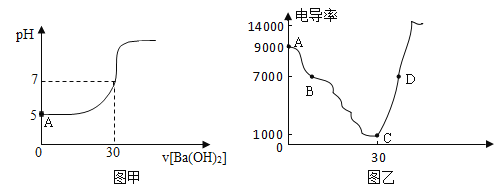
(1)硫酸铜和氢氧化钡溶液发生反应的化学方程式为:_____;实际参加反应的微粒是_____。
(2)图甲中A点所示溶液中,含有的阳离子有_____。
(3)将打磨过的铝片放入上述硫酸铜溶液中,可以观察到的现象是:_____。
(4)某中学学生用电导仪测该实验过程中溶液的电导率(电导率越高表示溶液的导电性越好),如图乙;D点所示溶液能导电是因为溶液中含有的微粒是_____。
【答案】CuSO4+Ba(OH)2=Cu(OH)2↓+BaSO4↓ Cu2+、Ba2+、SO42-、OH- Cu2+、H+ 铝片表面有红色固体析出,溶液由蓝色逐渐变为无色,且铝片表面有气泡产生 Ba2+、OH-
【解析】
(1)因为硫酸铜和氢氧化钡都溶于水,氢氧化铜和硫酸钡都难溶于水,所以硫酸铜和氢氧化钡溶液能发生反应生成氢氧化铜和硫酸钡沉淀,化学方程式为:CuSO4+Ba(OH)2=Cu(OH)2↓+BaSO4↓;在该反应中Cu2+和OH-结合生成氢氧化铜沉淀,Ba2+和SO42-结合生成硫酸钡沉淀,因此实际参加反应的微粒是:Cu2+、Ba2+、SO42-、OH-。
(2)图甲中A点所示溶液是硫酸铜溶液,因为硫酸铜是由铜离子和硫酸根离子构成的,溶于水能解离出铜离子和硫酸根离子,故溶液中含有的金属阳离子是:Cu2+;又因为图甲中A点所示溶液pH=5,溶液呈酸性,这是溶液中的铜离子水解产生H+造成的,所以溶液中还含有阳离子:H+。根据以上分析,图甲中A点所示溶液中含有的阳离子有:Cu2+、H+。
(3)因为铝的金属活动性比铜强,铝能置换出硫酸铜溶液中的铜,硫酸铜溶液呈蓝色,而硫酸铝溶液呈无色,所以将打磨过的铝片放入题中所述硫酸铜溶液中,可以观察到的现象有:铝片表面有红色固体析出,溶液由蓝色逐渐变为无色。又因为该硫酸铜溶液pH=5,呈酸性,溶液中含有一定量的H+,铝在金属活动性顺序中排在氢前面,所以反应中有氢气生成,故同时还可以看到铝片表面有气泡产生。根据以上分析,将打磨过的铝片放入题中所述硫酸铜溶液中,可以观察到的现象是:铝片表面有红色固体析出,溶液由蓝色逐渐变为无色,且铝片表面有气泡产生。
(4)某学生用电导仪测出的该实验过程中溶液的电导率变化,如图乙所示。从A点到C点,电导率逐渐降低,原因是溶液中自由移动的Cu2+和SO42-分别与加入的OH-和Ba2+结合生成难解离的氢氧化铜和硫酸钡沉淀,自由移动的离子随加入的氢氧化钡增加而逐渐减少,到C点电导率最低,说明此时溶液中Cu2+、SO42-和加入的氢氧化钡溶液中的Ba2+、OH-恰好完全反应;而从C点到D点,电导率逐渐升高,原因是加入的氢氧化钡溶液中的OH-和Ba2+没有与其他离子结合生成难解离的物质,随着氢氧化钡溶液的增加,溶液中自由移动的OH-和Ba2+逐渐增加。因此D点所示溶液能导电是因为溶液中含有的能自由移动的带电粒子是:Ba2+、OH-。