题目内容
【题目】铜的化合物是中学化学学习和研究的重要内容:
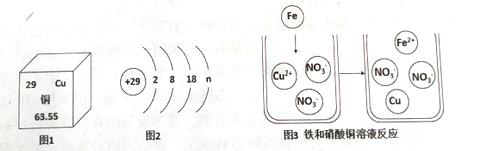
(1)铜元素位于元素周期表中第__________周期,铜原子的质子数为_______________。
(2)图2中n的值为_______________。
(3)图3可知,从微观角度看实质,参与反应的微观粒子是_______________和____________(化学符号表示)。
(4)依据图1图2的信息,下列说法不正确的是_______________。
A 铜原子的中子数为29
B 铜原子在化学反应中易失去电子
C 铜的相对原子质量是63.55g
D 铜元素在化合物中可以显+1价
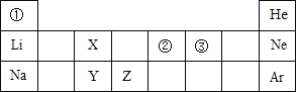
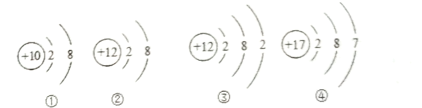
(5)下列所示的粒子共表示_______________种元素。
【答案】四 29 1 Fe Cu2+ AC 3
【解析】
(1)元素在元素周期表中的周期数等于其原子核外的电子层数,铜原子核外有四个电子层,所以铜元素位于第四周期;由铜的元素周期表的信息可知,铜原子核内的质子数为29,
(2)在原子中,质子数=核外电子数,图2中n的值=29-2-8-18=1;
(3)图3可知,其实质是铁原子和铜离子反应生成铜原子和亚铁离子;从微观角度看实质,参与反应的微观粒子是Fe和Cu2+;
(4)A、由铜的元素周期表的信息可知,铜原子核内的质子数为29,而不是中子数,故A错误;
B、铜原子的最外层只有一个电子,所以在化学反应中易失去电子,故B正确;
C、相对原子质量的单位是“1”,不是“g”,常省略不写,铜的相对原子质量是63.55,故C错误;
D、铜原子的最外层只有一个电子,所以在化学反应中失去最外层的1个电子,化合价显+1价,故C正确。故选AC;
(5)元素是具有相同核电荷数(质子数)的同一类原子的总称,不同的元素质子数不同,所示的粒子共有3种不同质子数,表示3种元素。