题目内容
【题目】如图是 a、b、c 三种物质的溶解度曲线。
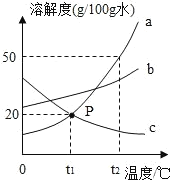
(1)溶液在点 P 时处于_____(填”饱和”或”不饱和”)状态。
(2)t2℃时,50 克水中最多能溶解 a 物质_____克。
(3)除去 a 固体中混有的少量 b,提纯的步骤是:加水溶解、 蒸发浓缩、_____,然后过滤、洗涤、干燥。
(4)t2℃时,将 a、b、c 三种物质的饱和溶液降温至t1℃,下列说法正确的是_____。
A 溶质质量分数:b > a > c
B 析出固体的质量 a > b,c 无固体析出
C 溶剂的质量:a < b < c
D a、b 是饱和溶液,c 是不饱和溶液。
【答案】饱和 25 降温结晶 AD
【解析】
(1)因为P点在曲线上,所以溶液在P点时处于饱和状态。
(2)t2℃时,a的溶解度为50g,即t2℃时100g水中最多溶解50g a物质,所以t2℃时,50克水中最多能溶解a物质25g。
(3)a 的溶解度受温度影响较大,除去 a 固体中混有的少量 b,提纯的步骤是:加水溶解、蒸发浓缩、降温结晶,然后过滤、洗涤、干燥。
(4)A 假设t2℃时,三种溶液溶剂的质量均为100g,则t1℃时,a的溶质质量为20g,b的溶质质量大于20g,c的溶质质量小于20g,所以溶质质量分数:b > a > c,A正确;
B 因为溶液的质量不确定,所以无法比较析出晶体的质量,B错误;
C 降温过程中溶剂质量不变,t2℃时,三种溶液溶剂质量不能确定,降温到t1℃时,溶剂质量也不能确定,C错误;
D 将 a、b、c 三种物质的饱和溶液从t2℃降温至t1℃,因为a、b的溶解度随温度降低而减小,所以温度降低,析出晶体,此时a、b的溶液仍为饱和溶液,而c的溶解度随温度降低而增大,c 无晶体析出,也不再是饱和溶液, D正确;故选AD。

 名校课堂系列答案
名校课堂系列答案