题目内容
【题目】以下是甲、乙两同学对有关镁与盐酸反应的系列研究。
研究一:镁与盐酸反应过程中的能量变化以及反应速率的变化:
(1)反应中试管外壁发烫,说明镁与稀盐酸反应是 反应(填 “吸热”或“放热”)。
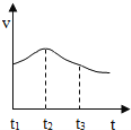
(2)实验测得镁片产生气体的速率(v)与时间(t)的关系如右图所示,则t1~t2时间内反应速率逐渐加快的主要原因是 。
研究二:反应后所得溶液的酸碱性探究:
(3)甲同学反应后用pH试纸测定试管中溶液的酸碱性,发现pH小于7,说明甲同学所得溶液呈 性(选填“酸”“碱”或“中”)。
甲同学:猜想Ⅰ:稀盐酸过量,使溶液pH小于7;猜想Ⅱ:氯化镁溶液pH小于7。为验证猜想,甲同学需测定 溶液的酸碱性,实验表明该溶液显弱酸性。
下列使用pH试纸的方法正确的是 (填字母).
A.将pH试纸剪成几段节约使用
B.将pH试纸直接插入待测液中
C.将pH试纸放在干净的白瓷板上,用玻璃棒蘸取待测液滴在pH试纸上
D.将pH试纸润湿后放在玻璃片上,用玻璃棒蘸取待测液滴在pH试纸上
(4)乙同学重复甲同学实验时,发现反应后所得试管中溶液pH大于7。发现实验与甲同学实验不同的是,反应后的试管中镁条有剩余。乙同学猜想可能是镁与热水反应生成了碱性物质。乙同学为验证猜想,在滴有两滴酚酞的热水中放入一段打磨过的镁条,观察到溶液很快变为红色,同时还观察到镁条表面有气体生成,收集并点燃该气体,发现能燃烧,请根据实验现象写出镁与水反应的化学反应方程式 。
(5)活泼金属能与水在一定条件下反应。实验发现钠与冷水剧烈反应,产生大量的气体。由此可见金属与水反应与金属的活动性顺序 (填“有关”或“无关”)。
研究三:确定镁条的成分:
称取3.2g表面被氧化的镁条(表面物质作为氧化镁), 放入100g稀盐酸中恰好完全反应,生成气体0.2g。求:
(6)此镁条中金属镁的质量,反应后所得溶液中溶质的质量分数。(计算结果保留一位小数)(写出计算过程,共4分)
【答案】(1)放热;(2)反应放热,溶液温度升高使反应速率加快;
(3)酸性 氯化镁 AC(全对给分)(4)Mg+2H2O═Mg(OH)2+H2↑(5)有关(6)11.1%
【解析】
试题分析:(1)反应中试管外壁发烫,说明镁与稀盐酸反应是放热反应;(2)t1~t2时间内反应速率逐渐加快的主要原因是反应放热,溶液温度升高使反应速率加快;(3)pH小于7的溶液呈酸性,故该溶液呈酸性;稀盐酸的pH小于7,故若想验证甲同学的猜想,需测定氯化镁溶液的酸碱性;使用pH试纸的正确操作为:将pH试纸放在白瓷板或玻璃片上,用玻璃棒蘸取待测液滴到pH试纸上,观察并与标准比色卡比较,为了节约,可以将pH试纸剪成几段,故选AC;(4)在滴有两滴酚酞的热水中放入一段打磨过的镁条,观察到溶液很快变为红色,说明生成了碱性物质;同时还观察到镁条表面有气体生成,收集并点燃该气体,发现能燃烧,说明生成了可燃性气体,根据质量守恒定律中反应前后元素的种类不变,可知该反应的产物是氢氧化镁和氢气,反应的方程式为:Mg+2H2O![]() Mg(OH)2+H2↑;(5)钠与冷水就能剧烈反应,而镁与水反应需要加热,由此可知金属与水的反应与金属活动性顺序有关;(6)镁条与盐酸反应生成氯化镁和氢气,已知生成氢气的质量为0.2g,根据方程式可以求出镁条中金属镁的质量;氧化镁与盐酸反应生成氯化镁和水,故充分反应后,溶液中溶质为氯化镁,其质量为镁条、氧化镁与盐酸反应生成的氯化镁的总质量;溶液的质量为:镁条的质量与盐酸的质量之和减去产生的氢气的质量。
Mg(OH)2+H2↑;(5)钠与冷水就能剧烈反应,而镁与水反应需要加热,由此可知金属与水的反应与金属活动性顺序有关;(6)镁条与盐酸反应生成氯化镁和氢气,已知生成氢气的质量为0.2g,根据方程式可以求出镁条中金属镁的质量;氧化镁与盐酸反应生成氯化镁和水,故充分反应后,溶液中溶质为氯化镁,其质量为镁条、氧化镁与盐酸反应生成的氯化镁的总质量;溶液的质量为:镁条的质量与盐酸的质量之和减去产生的氢气的质量。

【题目】善于用化学的眼光看世界,能够提高我们的科学素养。下列事实和相应的解释正确的是
事实 | 解释 | |
A | 切洋葱时可闻到刺激性气味 | 分子之间有一定的间隔 |
B | 金刚石坚硬而石墨很软 | 碳原子的排列方式不同 |
C | 水是由氢元素和氧元素组成的 | 水分解生成氢气和氧气 |
D | 黄铜片比铜片硬 | 合金的硬度一般比纯金属的硬度小 |