题目内容
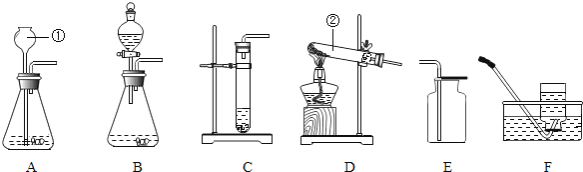
【题目】实验室常用下列装置制取气体,请你根据所学知识回答下列问题。

(1)、写出编号所指仪器的名称:①、 ②、
(2)、以上装置图中共有两处明显的错误,请你找出错误的地方并把改正的结果填在下列横线上:
①、 ②、
上述装置改进后,请继续回答下列问题。
(3)、小李在实验中用氯酸钾和另一种固体制取氧气,她选择上述装置中的A和 (填字母)进行组装,小红在实验中选用C装置作为氧气的发生装置。在他们的实验中都用到了一种相同的固体药品是 (填化学式),起了相同的作用。写出小红制取氧气的化学方程式
(4)、实验室选用C和E装置还可以制取的气体是 ,写出实验室制取该气体的化学方程式
【答案】(1)长颈漏斗 集气瓶(2)A图试管口略向下倾斜 E图导气管伸到试管底部
(3) F MnO2 2H2O2 ![]() 2H2O+O2↑(4) CO2 CaCO3+2HCl= CaCl2+ H2O+ CO2↑
2H2O+O2↑(4) CO2 CaCO3+2HCl= CaCl2+ H2O+ CO2↑
【解析】
试题分析:(2) ABC是制取气体的发生装置,DEF是收集气体的装置;根据反应物的状态和条件对装置进行选择,由气体的密度选择收集方法进而选择收集装置.但A装置试管口略向下倾斜,否则会产生试管破裂;E装置的导气管伸到试管底部,否则收集气体不纯;
(3)因为氧气密度大于空气,向上排空气法,故用E;由于其难溶于水,排水法收集,故用F;
加二氧化锰作催化剂 2H2O2![]() 2H2O+O2↑
2H2O+O2↑
(4)实验室选用C和E装置是常温下固液型制气体,可制CO2即CaCO3+2HCl= CaCl2+ H2O+ CO2↑

练习册系列答案
相关题目