��Ŀ����
����Ŀ���ߴ�����п�㷺Ӧ���ڵ��ӹ�ҵ,ij�о�С��������������Ʊ��ߴ�����п(����������ǡ����ȫ��Ӧ);

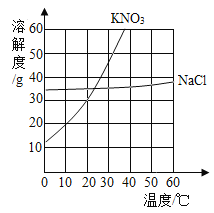
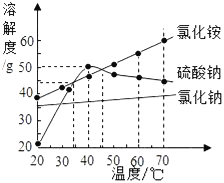
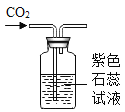
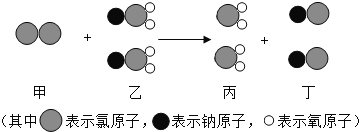
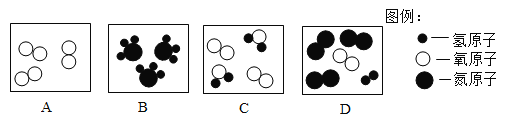
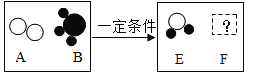
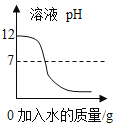
��1������Ӧ�ٵõ����Ȼ�п��Һ�к��еĽ�����������_________��(�����ӷ���)
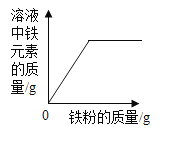
��2�����뷴Ӧ�ڵ����������������__________�����貣��������©�����ձ���___________��
��3��д���������Ȼ����ũҵ�ϵ�һ����;_________________________________________��
��4����Ӧ�����ڷֽⷴӦ,���õ�����п��������ֳ�������������÷�Ӧ�Ļ�ѧ����ʽΪ________________________________��
���𰸡�Zn2+ ���� ������ ���� ![]()
��������
��1��п�����ᷴӦ�����Ȼ�п������������Ӧ�ٵõ����Ȼ�п��Һ�к��еĽ�����������п���ӣ������ӷ���Ϊ��Zn2+��
��2����������ͼ��֪�����뷴Ӧ�ڵ�������õ���һ����Һ��һ�ֳ�������������Һ����룬����������ǹ��ˣ����貣��������©�����ձ��Ͳ�������
��3���������Ȼ���к��е�Ԫ�أ���ũҵ�ϵ�һ����;�ǵ��ʣ�
��4����Ӧ�����ڷֽⷴӦ�����õ�����п��������ֳ���������������������غ㶨�ɿ�֪�����ֳ�������������ֱ�Ϊһ����̼�Ͷ�����̼���÷�Ӧ�Ļ�ѧ����ʽΪ��![]() ��
��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д�