题目内容
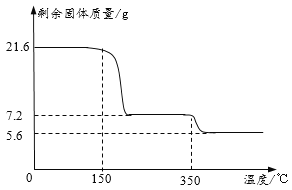
【题目】某化学兴趣小组的同学为测定石灰石样品中碳酸钙的质量分数,设计如下实验。用天平秤取12.5g石灰石样品放入小烧杯中;加入50g的稀盐酸,充分反应后称量剩余物的质量为58.1g,并测得溶液的pH值为4。
(1)测得溶液pH的目的是_____。
(2)求石灰石中碳酸钙的质量分数_____?
【答案】测试稀盐酸是否反应完全 80%
【解析】
(1)用pH试纸测得反应后溶液,以判断稀盐酸是否反应完全;
(2)根据质量守恒定律可知:反应后比反应前减少的质量是生成二氧化碳的质量;根据化学方程式由二氧化碳的质量可以计算出石灰石中碳酸钙的质量,进而计算出石灰石中碳酸钙的质量分数。
解:(1)用pH试纸测得反应后溶液的目的是测试稀盐酸是否反应完全;
(2)根据质量守恒定律,二氧化碳的质量为:12.5g+50g-58.1g=4.4g,设该石灰石样品中碳酸钙的质量为x,
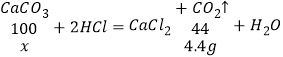
![]()
x=10g,
石灰石中碳酸钙的质量分数=![]() ×100%=80%。
×100%=80%。

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
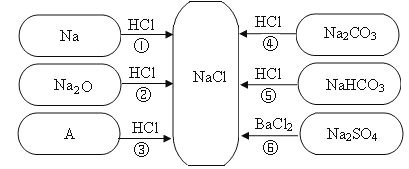
假期作业暑假成长乐园新疆青少年出版社系列答案【题目】实验室有一瓶标签残缺并且瓶盖没有完全密封的无色溶液(如图),是NaCl、NaOH、Na2CO3、NaHCO3中的一种溶液,为确认原瓶中是何种溶质并判断其是否变质,进行了如下的究活动:
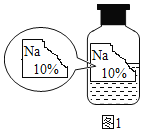
(查阅资料)
Ⅰ.BaCl2溶液呈中性;
Ⅱ.常温下,有关物质的相关信息如表:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
常温下的溶解度(g/100g水) | 36 | 109 | 21.5 | 9.6 |
常温下稀溶液的pH | 7 | 13 | 11 | 9 |
从物质的相关信息可知,原溶液的溶质一定不是 NaHCO3因为_____。
(进行实验)
①取少量样品,测得溶液的pH大于7,则原溶液的溶质肯定不是_____。
②另取样品又进行了如下实验,实验过程如图:
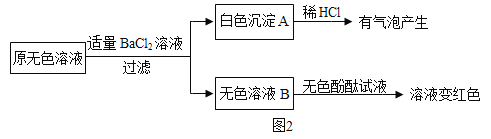
生成白色沉淀A的化学方程式_____。通过实验可以判断样品原无色溶液中含有的溶质有_____。
下列试剂能替代上述实验中无色酚酞试液检验的是_____。(填序号)
Ⅰ.FeCl3 Ⅱ.HNO3 Ⅲ.CO2 Ⅳ.CuO
(获得结论)实验完成后,最终得到的结论:原瓶中的溶质是_____,且已变质;变质的原因是(用化学方程式表示)_____。