题目内容
【题目】有关质量守恒定律的理解或应用正确的是
A. 10g 氢氧化钠溶液与 10g 硫酸铜溶液混合,得到 20g 溶液
B. 1g 碳酸钙粉末与 10g 水混合,形成 11g 溶液
C. 5g 硫和 5g 氧气在点燃条件下完全反应,生成物质量为 10g
D. 甲烷燃烧时,甲烷减少的质量等于生成的 CO2 和 H2O 的质量总和
【答案】C
【解析】
A、氢氧化钠与硫酸铜反应生成氢氧化铜沉淀,不属于溶液,所以溶液质量小于20g,故A错;
B、碳酸钙不溶于水,1g碳酸钙粉末与10g水混合,形成悬浊液,不能形成11g溶液,故C错;
C、硫与氧气反应的化学方程式为![]() ,参加反应的硫、氧气与生成二氧化硫的质量之比为32:32:64=1:1:2,5g硫和5g氧气完全反应后,生成物质量为10g,故C正确;
,参加反应的硫、氧气与生成二氧化硫的质量之比为32:32:64=1:1:2,5g硫和5g氧气完全反应后,生成物质量为10g,故C正确;
D、甲烷燃烧时,参加反应的甲烷和氧气的质量和等于生成二氧化碳和水的质量和,故D错误。
故选C。

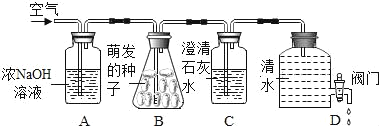
【题目】某白色固体可能含有BaCl2(溶液显中性)、NaOH、Na2CO3、Na2SO4中的一种或几种,某小组同学为确定该白色固体的成分,进行如下探究。
①初步探究:实验设计如图所示。
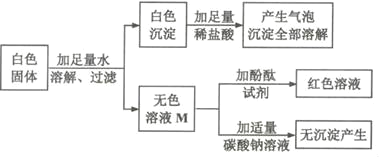
(初步结论)原白色固体中一定有的物质是_____。M溶液中的溶质一定有_____,一定没有氯化钡。
(交流讨论)甲同学认为:无色溶液M变红色,说明溶液M中含有碱性物质,但不能说明原白色固体中是否含有氢氧化钠,需要进一步确定。
②继续探究:无色溶液M中是否含有氢氧化钠?
(实验探究)
实验步骤 | 实验现象 | 实验目的 |
A.取溶液M于试管中,加入 _____,振荡,静置 | 白色沉淀 | _____ |
B.取实验A所得的上层清液于试管中,加入酚酞试剂。 | 清液变红色 | 证明溶液M中有氢氧化钠 |
通过实验,小组同学完成了本次探究活动。 | ||
【题目】目前全世界的镍(Ni)消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍常用于各种高光泽装饰漆和塑料生产,也常用作催化剂。
Ⅰ.(镍粉制备)
工业用电解镍新液(主要含NiSO4,NiCl2等)制备碱式碳酸镍晶体[xNiCO3●yNi(OH)2●ZH2O],并利用其制备镍粉的流程如下:
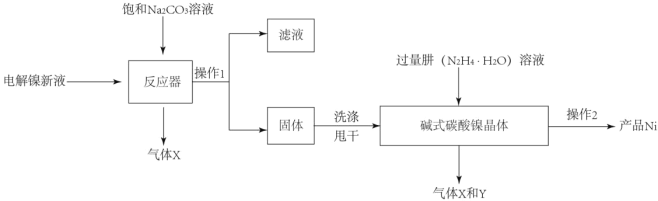
(1)反应器中的一个重要反应为3NiSO4+3Na2CO3+2H2O=NiCO32Ni(OH)2+3Na2SO4+2X,X的化学式为_____。
(2)物料在反应器中反应时需要控制反应条件。
分析下图,反应器中最适合的温度及pH分别为_____℃、_____。
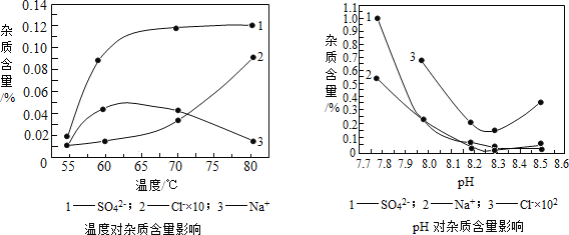
(3)生产中,pH逐渐增加,生成Ni(OH)2含量也相对增加,则生成的碱式碳酸镍晶体中,镍的含量将_____(填“升高”、“降低”或“不变”)。
(4)操作2含过滤、水洗、95%酒精浸泡、晾干等操作,其中用95%酒精浸泡的目的是_____。
Ⅱ.(测定碱式碳酸镍晶体的组成)
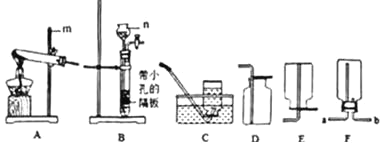
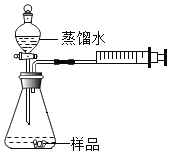
为测定碱式碳酸镍晶体[xNiCO3●yNi(OH)2●ZH2O]组成,某小组设计了如下实验方案及装置:
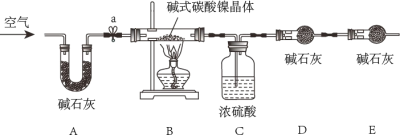
(资料卡片)
①碱式碳酸镍晶体受热会完全分解生成NiO、CO2和H2O
②碱石灰是NaOH和CaO的混合物,可以吸收CO2和H2O
(实验步骤)
①检查装置气密性;②准确称量3.77g碱式碳酸镍晶体[xNiCO3●yNi(OH)2●ZH2O]放在B装置中,连接仪器;③打开弹簧夹a,鼓入一段时间空气,分别称量装置C、D、E的质量;
④关闭弹簧夹a,加热装置B至装置C中导管末端无气泡冒出;⑤打开弹簧夹a,缓缓鼓入一段时间空气;⑥分别准确称量装置C、D、E的质量;⑦根据数据进行计算(相关数据如下表)
装置C/g | 装置D/g | 装置E/g | |
加热前 | 250.00 | 190.00 | 190.00 |
加热后 | 251.08 | 190.44 | 190.00 |
(实验分析及数据处理)
(1)实验过程中步骤⑤鼓入空气的目的是_____。
(2)计算3.77g碱式碳酸镍晶体[xNiCO3●yNi(OH)2●ZH2O]中镍元素的质量_____。最终通过计算得到了碱式碳酸镍晶体的组成。
(实验反思)
(3)另一小组同学加热时在酒精灯上加了铁丝网罩,实验结束后,称得装置B中残留固体质量明显增大。经查阅资料发现:在温度控制不当导致温度过高时,NiO会被氧化成Ni2O3。该组同学称得残留的固体中镍元素的质量分数可能是_____。
A 70.1% B 75.9% C 78.7% D 79.6%