题目内容
【题目】下图是KNO3和NaCl的溶解度曲线。

(1)20℃时,在100g水中加入40gNaCl固体,所形成的溶液是_______(填“饱和”或“不饱和”)溶液。
(2)50℃时,KNO3溶液的质量分数最大值是____________(只列计算式)。
(3)将50℃KNO3的饱和溶液降温到20℃,其溶液质量分数_______(填“变大”或“变小”或“不变”)。
(4)欲从NaCl溶液中获得大量的NaCl晶体,采用的方法是___________________。
【答案】 饱和 ![]() 100% 变小 蒸发(溶剂)结晶
100% 变小 蒸发(溶剂)结晶
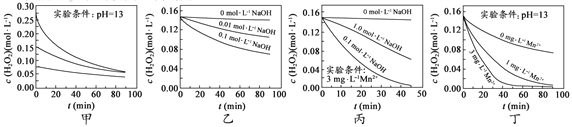
【解析】(1)由溶解度曲线可知,20℃时氯化钠的溶解度是36.0g,故向100g的水中加入40g的氯化钠后,不能完全溶解,故所得的溶液是饱和溶液;
(2)50℃时,KNO3的溶解度是85.5g,故该温度下硝酸钾的饱和溶液的质量分数最大,质量分数为![]() 100%;
100%;
(3)硝酸钾的溶解度随温度的升高而升高,故50℃时,KNO3的饱和溶液降温至20℃时,仍然是饱和溶液,并且有硝酸钾晶体析出,故降温后其溶液中溶质的质量分数变小;
(4)NaCl的溶解度随温度的升高而升高,随温度的变化不大,故应该采用蒸发结晶的方法获得大量的NaCl晶体。

 一诺书业暑假作业快乐假期云南美术出版社系列答案
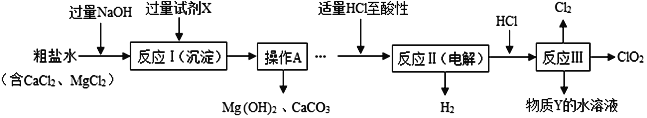
一诺书业暑假作业快乐假期云南美术出版社系列答案【题目】化学小组的同学用下图所示装置进行如下实验,实验前K1、K2、K3均为关闭状态。
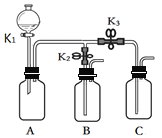
内容 步骤 | 实验步骤 |
实验1 | B、C中分别盛有无色酚酞试液,打开K1,从分液漏斗中加入浓氨水,关闭K1,然后打开K2、K3。 |
实验2 | A中盛满CO2,B中盛有氢氧化钙溶液,C中盛有稀盐酸。 ①打开K1,从分液漏斗慢慢放入适量的氢氧化钠溶液,关闭K1。 ②一段时间后打开K2,观察到有A中有沉淀产生时,迅速关闭K2。 ③再打开K3,观察到A中有气泡产生。 |
(1)实验1中,可以观察到的现象是__________。
(2)实验2中,步骤①中所发生反应的化学方程式为____________________。
(3)实验2中,请解释步骤③产生气泡的原因为____________________。
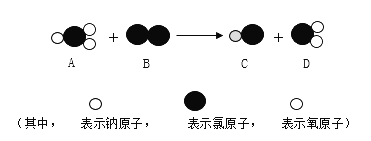
【题目】甲、乙、丙三种物质的转化关系如右图所示(“→”表示反应一步实现,部分物质和反应条件已略去)。下列选项不能实现图示转化的是
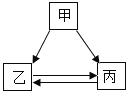
选项 | 甲 | 乙 | 丙 |
A | H2SO4 | H2 | H2O |
B | C | CO | CO2 |
C | Ca(OH)2 | CaCl2 | CaCO3 |
D | NaOH | NaCl | NaNO3 |
A. A B. B C. C D. D