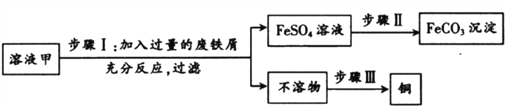
题目内容
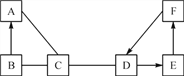
【题目】(1)如图1是元素周期表中的一部分,图2是铜原子的结构示意图。据图回答:
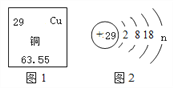
①图2中n的值为____;铜元素位于元素周期表中的第____周期。
②古代青铜器工艺精湛,但出土的青铜器表面大都锈蚀,锈蚀部分存在CuCl,CuCl的化学名称为________,为防止出土的青铜器再锈蚀,文物工作者将糊状Ag2O涂在被腐蚀部位,Ag2O与CuCl发生复分解反应,可以防止青铜器进一步被腐蚀,写出该反应的化学方程式_______。某新出土的青铜器通过分析测得Sn、Pb的质量分别为119 g、20.7 g,则该青铜器中Sn和Pb原子的数目之比为__。
(2)二氧化氯(ClO2)是一种高效净水剂。以粗盐为原料生产ClO2的工艺主要包括:A. 粗盐精制;B. 特殊条件下电解NaCl溶液制NaClO3;C. ClO2的制取。工艺流程如图。
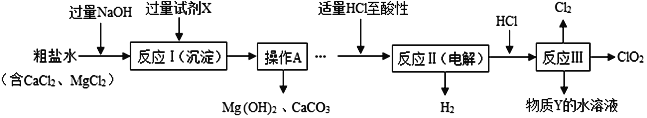 (其中反应Ⅲ制取ClO2的化学方程式为:2NaClO3+4HCl==2ClO2↑+Cl2↑+2NaCl+2H2O)
(其中反应Ⅲ制取ClO2的化学方程式为:2NaClO3+4HCl==2ClO2↑+Cl2↑+2NaCl+2H2O)
①试剂X中溶质的化学式为________________;操作A名称_____________。
②分析完成反应Ⅱ的化学方程式:_______________________________。
③我国最近已研究出ClO2的新制法,其反应的微观过程如图所示:
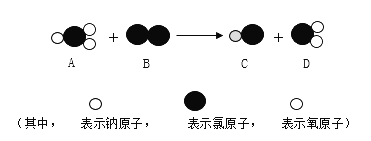
该反应的化学方程式是___________________;该反应中,反应物和生成物所属物质类别有________类。
(3)下图中A~H是初中化学常见的物质。B是最常用的溶剂,E有很好的抗腐蚀性能;D、E、F、H是四种不同类别的物质,且均含有地壳中含量最高的金属元素;四个虚线圈中的反应各属于四个不同的基本反应类型。图中“—”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去。
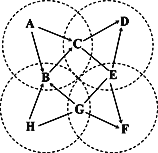
①写出H的化学式:___________。
②写出相关的反应的化学方程式:A→C:_____________; E—G:______________。
③G中一定含有(填元素符号)_______元素。
【答案】 1 四 氯化亚铜 Ag2O+2CuCl= 2 AgCl + Cu2O 10:1 Na2CO3 过滤 NaCl+3H2O ![]() H2O+NaClO3+3H2↑ 2NaClO2 + Cl2 = 2NaCl + 2ClO2 三 Al(OH)3 2H2O2
H2O+NaClO3+3H2↑ 2NaClO2 + Cl2 = 2NaCl + 2ClO2 三 Al(OH)3 2H2O2 ![]() 2H2O+ O2↑ 2Al+6HCl═2AlCl3+3H2↑ H
2H2O+ O2↑ 2Al+6HCl═2AlCl3+3H2↑ H
【解析】(1)①同一原子中,质子数=核外电子数,图2中n的值为1;在元素周期表中,周期数等于原子的电子层数,铜元素位于元素周期表中的第四周期;②CuCl中铜元素显+1价,根据化合物的命名原则,CuCl的化学名称为氯化亚铜,复分解反应就是两种化合物相互交换成分生成两种新的化合物的反应,Ag2O与CuCl发生复分解反应,该反应的化学方程式Ag2O+2CuCl= 2 AgCl + Cu2O;Sn、Pb的质量分别为119 g、20.7 g,Sn、Pb的相对原子质量分别为:119、207,则该青铜器中Sn和Pb原子的数目之比为:![]() =10:1;(2)①由流程图可知,试剂X将氯化钙转化成碳酸钙沉淀,所以其溶质是碳酸钠,化学式为:Na2CO3;操作A将难溶固体与液体分离,应是过滤操作;②反应Ⅲ制取ClO2的化学方程式为:2NaClO3+4HCl==2ClO2↑+Cl2↑+2NaCl+2H2O,可知反应Ⅱ的生成物有氯酸钠,即电解食盐水的产物有氯酸钠,因此反应Ⅱ的化学方程式:NaCl+3H2O
=10:1;(2)①由流程图可知,试剂X将氯化钙转化成碳酸钙沉淀,所以其溶质是碳酸钠,化学式为:Na2CO3;操作A将难溶固体与液体分离,应是过滤操作;②反应Ⅲ制取ClO2的化学方程式为:2NaClO3+4HCl==2ClO2↑+Cl2↑+2NaCl+2H2O,可知反应Ⅱ的生成物有氯酸钠,即电解食盐水的产物有氯酸钠,因此反应Ⅱ的化学方程式:NaCl+3H2O ![]() H2O+NaClO3+3H2↑;③由图中信息可知,该反应的化学方程式是2NaClO2 + Cl2 = 2NaCl + 2ClO2;该反应中,Cl2是由一种元素组成的纯净物,是单质;NaClO2和NaCl是由金属和酸根组成的化合物,属于盐;ClO2是由两种元素组成,且其中一种元素是氧的化合物,属于氧化物,共三类物质;(3)A~H是初中化学常见的物质。四个虚线圈中的反应各属于四个不同的基本反应类型。由两种或两种以上物质生成一种物质的反应叫化合反应;由一种物质生成两种或两种以上物质的反应叫分解反应;由一中单质和一种化合物生成另一种和另一种化合物的反应叫置换反应。由两种化合物相互交换成分形成两种新的化合物的反应叫复分解反应。B是最常用的溶剂,所以B是水,E有很好的抗腐蚀性能,D、E、F、H是四种不同类别的物质,且均含有地壳中含量最高的金属元素——铝;所以E是铝,F是氯化铝,D是氧化铝,H是氢氧化铝,A是过氧化氢,C是氧气,G是酸——盐酸或硫酸。代入转化关系,检验推理正确。①H的化学式:Al(OH)3。②相关的反应的化学方程式:A→C(即过氧化氢分解生成水和氧气):2H2O2
H2O+NaClO3+3H2↑;③由图中信息可知,该反应的化学方程式是2NaClO2 + Cl2 = 2NaCl + 2ClO2;该反应中,Cl2是由一种元素组成的纯净物,是单质;NaClO2和NaCl是由金属和酸根组成的化合物,属于盐;ClO2是由两种元素组成,且其中一种元素是氧的化合物,属于氧化物,共三类物质;(3)A~H是初中化学常见的物质。四个虚线圈中的反应各属于四个不同的基本反应类型。由两种或两种以上物质生成一种物质的反应叫化合反应;由一种物质生成两种或两种以上物质的反应叫分解反应;由一中单质和一种化合物生成另一种和另一种化合物的反应叫置换反应。由两种化合物相互交换成分形成两种新的化合物的反应叫复分解反应。B是最常用的溶剂,所以B是水,E有很好的抗腐蚀性能,D、E、F、H是四种不同类别的物质,且均含有地壳中含量最高的金属元素——铝;所以E是铝,F是氯化铝,D是氧化铝,H是氢氧化铝,A是过氧化氢,C是氧气,G是酸——盐酸或硫酸。代入转化关系,检验推理正确。①H的化学式:Al(OH)3。②相关的反应的化学方程式:A→C(即过氧化氢分解生成水和氧气):2H2O2 ![]() 2H2O+O2↑; E—G:(即铝和盐酸反应生成氯化铝和氢气)2Al+6HCl═2AlCl3+3H2↑或铝和硫酸生成硫酸铝和氢气:2Al+3H2SO4 = Al2(SO4)3+3H2↑。③酸中一定含有氢元素-H。
2H2O+O2↑; E—G:(即铝和盐酸反应生成氯化铝和氢气)2Al+6HCl═2AlCl3+3H2↑或铝和硫酸生成硫酸铝和氢气:2Al+3H2SO4 = Al2(SO4)3+3H2↑。③酸中一定含有氢元素-H。

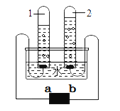
【题目】某兴趣小组同学利用下图所示装置进行“铝与硫酸铜溶液反应”的实验时,发现反应后试管中的溶液出现分层现象:

【实验现象】
时间 | 观察现象 |
3min | 铝条表面有红色固体出现,铝条所在位置及其上方溶液颜色逐渐变浅,下方溶液没有变化 |
0.5h | 铝条表面聚集大量红色物质,铝条周围溶液呈无色透明,下方溶液仍为蓝色,无色溶液和蓝色溶液界面清晰 |
(1)写出铝和硫酸铜溶液反应的化学方程式___________________。
(2)实验前打磨铝条并将其绕成螺旋状的目的分别是_______________、_______________
(3)根据实验现象判断,铜与铝的金属活动性关系为___________________。
(4)根据反应后明显分层的溶液判断,生成的硫酸铝溶液密度_______(填“>”或“=”或“<”)原硫酸铜溶液密度,根据反应前后物质质量的关系分析,导致这种结果的原因可能是_______________。
附加分:若正确回答下列小题,将获得4分的奖励,但化学试卷总分不超过60分。
(5)为促进铝与硫酸铜溶液反应,在配制硫酸铜溶液时加入少量NaCl。
【提出问题】为什么在硫酸铜溶液中加入NaCl,有利于铝与硫酸铜溶液反应?
【提出假设】Cl的存在有利于铝与硫酸铜溶液反应。
【设计实验】请你设计一个合理的实验验证该假设_______________________________。
除以上方案外,你还能想到的另一种方案是_______________________________。