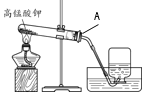
题目内容
【题目】某纯碱样品中含有少量氯化钠,现取该样品12g溶解在100g水中,再向其中逐滴加入氯化钙溶液,产生的沉淀与加入氯化钙溶液的质量关系如图所示:
计算:
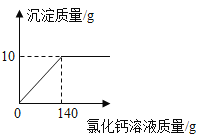
(1)纯碱中碳酸钠的质量分数![]() 结果精确到
结果精确到![]() ,下同
,下同![]() ______;
______;
(2)恰好完全反应时,所得溶液中溶质的质量分数_______。
【答案】88.3% 5.4%
【解析】
碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钙。反应方程式为:Na2CO3+CaCl2═CaCO3↓+2NaCl。
解(1)设纯碱样品中碳酸钠的质量为x,生成氯化钠的质量为y,

![]() ,
,
得x=10.6g,y=11.7g,
纯碱样品中碳酸钠的质量分数:![]() ×100%
×100%![]() 88.3%,
88.3%,
(2)所得溶液中的溶质为氯化钠,来源为样品中的少量氯化钠和反应生成的氯化钠,其质量分数为![]() ×100%
×100% ![]() 5.4%。
5.4%。
答:(1)纯碱中碳酸钠的质量分数约 88.3%;(2)恰好反应时,所得溶液中溶质的质量分数约为5.4%。

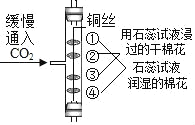
【题目】验证某混合气体含有CO和H2,并除去含有的少量CO2杂质。甲同学进行了如下实验:
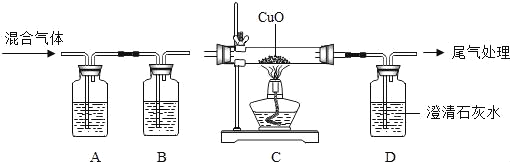
(1)A中氢氧化钠溶液的作用是_____,B中浓硫酸的作用是吸收水分,观察到C中黑色氧化铜变_____,D中澄清石灰水变浑浊,写出D中反应的化学方程式_____。
(2)乙同学认为上述实验现象不能确定混合气体含有H2,他改进实验后证明了混合气体中含有H2.请写出乙同学的实验改进方法和现象_____。从环境保护角度,该实验中最后导出的尾气处理方法是_____。
(3)丙同学对A装置反应后的溶液成分进行验证,请根据实验现象填写下列空白处:
实验操作过程 | 实验现象 | 实验结论 |
Ⅰ.取待测液少量于试管中,向其中滴加适量溶液 | 产生白色沉淀 | 溶液中含Na2CO3 |
Ⅱ.将上述反应后的混合物静置后,再向上层清液中加入溶液。 | 溶液呈红色 | 溶液中含NaOH |
若将Ⅱ中加入的溶液换成_____(写化学式),也可得出Ⅱ中相同的结论。
写出相应的化学方程式为:_____。
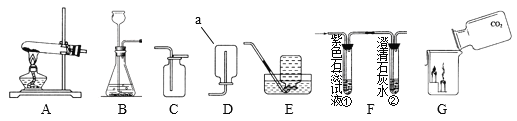
【题目】请从A或B两题中任选1个作答,若两题均作答,按 A计分。
A用下图装置制取氧气 | B用下图装置制取二氧化碳 |
| |
(1)仪器a的名称是_______。 (2)制氧气的化学方程式为________。 (3)能用排水法收集氧气的原因是_______。 | (1)仪器b的名称是_______。 (2)制二氧化碳的化学方程式为_______。 (3)能用向上排空气法收集二氧化碳的原因是_______。 |
【题目】实验室部分装置如图所示,请回答下列问题:
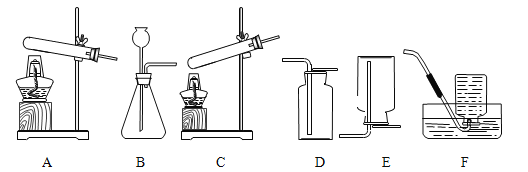
(1)选择发生和收集O2的装置,填写在下表中(填字母)。
选用药品 | 发生装置 | 收集装置 |
H2O2溶液,MnO2 | ____ | ____ |
KMnO4 | ____ |
(2)如果用加热浓氨水(NH3·H2O)制备氨气(NH3),可选用的发生装置是______(填字母)。
(3)选用F装置收集气体时,下列实验操作不正确的是_________(填序号)。
①反应前,将集气瓶注满水,用玻璃片盖着瓶口,倒立在盛水的水槽中;
②开始反应后,有气泡排出时,将导管口移入集气瓶;
③收集气体后,将集气瓶盖上玻璃片再移出水槽。
(4)实验室用KC1O3和MnO2制备O2的化学方程式是______。