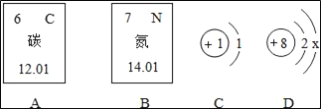
题目内容
【题目】下列实验设计能获得成功的是( )
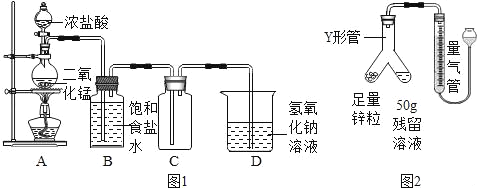
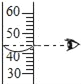
A. 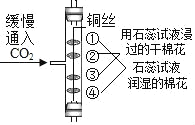 证明CO2密度比空气大且能与水反应产生酸
证明CO2密度比空气大且能与水反应产生酸
B. 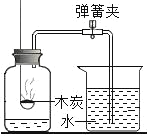 测定空气中氧气的含量
测定空气中氧气的含量
C. 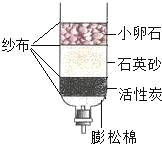 将河水转化为纯净水
将河水转化为纯净水
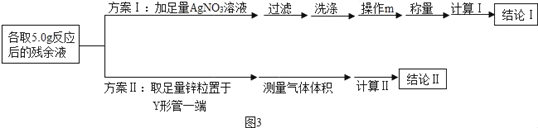
D. 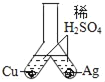 验证Cu和Ag的金属活动性大小
验证Cu和Ag的金属活动性大小
【答案】A
【解析】
A、实验过程中,②、③无明显现象,说明二氧化碳不能使石蕊变色,④、①先后变红色,说明二氧化碳密度比空气大,能和水反应生成碳酸,碳酸使石蕊试液变红色,符合题意;
B、木炭燃烧生成二氧化碳,消耗氧气的同时生成二氧化碳气体,导致水不能进入集气瓶,不能测定氧气含量,不符合题意;
C、实验过程中,通过过滤可以把不溶于水的物质除去,通过活性炭可以吸附色素、异味等物质,但是易溶于水的物质不能除去,不能将河水转化为纯净水,不符合题意;
D、实验过程中,无明显现象,说明金属活动性顺序中铜和银都排在氢后面,但是不能判断铜和银的活泼性,不符合题意。故选A。

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目