ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩ―ι÷ΛΡ≥ΜλΚœΤχΧεΚ§”–COΚΆH2Θ§≤Δ≥ΐ»ΞΚ§”–ΒΡ…ΌΝΩCO2‘”÷ ΓΘΦΉΆ§―ßΫχ––ΝΥ»γœ¬ Β―ιΘΚ
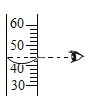
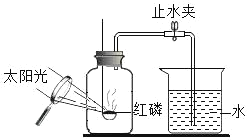
Θ®1Θ©A÷–«β―θΜ·ΡΤ»ή“ΚΒΡΉς”Ο «_____Θ§B÷–≈®ΝρΥαΒΡΉς”Ο «Έϋ ’Υ°Ζ÷Θ§Ιέ≤λΒΫC÷–ΚΎ…Ϊ―θΜ·Ά≠±δ_____Θ§D÷–≥Έ«ε ·Μ“Υ°±δΜκΉ«Θ§–¥≥ωD÷–Ζ¥”ΠΒΡΜ·―ßΖΫ≥Χ Ϋ_____ΓΘ
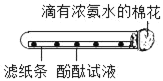
Θ®2Θ©““Ά§―ß»œΈΣ…œ ω Β―ιœ÷œσ≤ΜΡή»ΖΕ®ΜλΚœΤχΧεΚ§”–H2Θ§ΥϊΗΡΫχ Β―ιΚσ÷ΛΟςΝΥΜλΚœΤχΧε÷–Κ§”–H2Θ°«κ–¥≥ω““Ά§―ßΒΡ Β―ιΗΡΫχΖΫΖ®ΚΆœ÷œσ_____ΓΘ¥”ΜΖΨ≥±ΘΜΛΫ«Ε»Θ§ΗΟ Β―ι÷–ΉνΚσΒΦ≥ωΒΡΈ≤Τχ¥ΠάμΖΫΖ® «_____ΓΘ
Θ®3Θ©±ϊΆ§―ßΕ‘AΉΑ÷ΟΖ¥”ΠΚσΒΡ»ή“Κ≥…Ζ÷Ϋχ––―ι÷ΛΘ§«κΗυΨί Β―ιœ÷œσΧν–¥œ¬Ν–Ω’ΑΉ¥ΠΘΚ
Β―ι≤ΌΉςΙΐ≥Χ | Β―ιœ÷œσ | Β―ιΫα¬έ |
ΔώΘ°»Γ¥ΐ≤β“Κ…ΌΝΩ”Ύ ‘Ιή÷–Θ§œρΤδ÷–ΒΈΦ” ΝΩ»ή“Κ | ≤ζ…ζΑΉ…Ϊ≥ΝΒμ | »ή“Κ÷–Κ§Na2CO3 |
ΔρΘ°ΫΪ…œ ωΖ¥”ΠΚσΒΡΜλΚœΈοΨ≤÷ΟΚσΘ§‘Όœρ…œ≤ψ«ε“Κ÷–Φ”»κ»ή“ΚΓΘ | »ή“Κ≥ Κλ…Ϊ | »ή“Κ÷–Κ§NaOH |
»τΫΪΔρ÷–Φ”»κΒΡ»ή“ΚΜΜ≥…_____Θ®–¥Μ·―ß ΫΘ©Θ§“≤Ω…ΒΟ≥ωΔρ÷–œύΆ§ΒΡΫα¬έΓΘ
–¥≥ωœύ”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣΘΚ_____ΓΘ
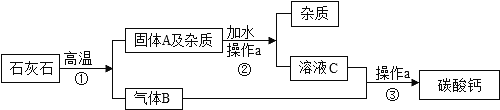
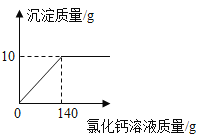
ΓΨ¥πΑΗΓΩΘ®1Θ©≥ΐ»ΞΕΰ―θΜ·ΧΦ ±δΚλ CO2+CaΘ®OHΘ©2ΓζCa CO3Γΐ+ H2O
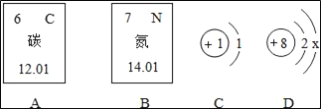
Θ®2Θ©‘ΎCΚΆD÷°ΦδΦ”ΈόΥ°ΝρΥαΆ≠Η…‘οΉΑ÷ΟΘ§ΑΉ…Ϊ±δάΕ…ΪΘ®ΚœάμΗχΖ÷Θ© Βψ»ΦΜρ ’Φ·(ΚœάμΦ¥Ω…)
Θ®3Θ©Φ”Ω…»ή–‘ΗΤ―ΈΘ®Μρ±Β―ΈΘ©Θ§ Ζ”ΧΣ Ω…»ή–‘Ά≠―ΈΜρΧζ―ΈΘ®ΚœάμΗχΖ÷Θ© NaOH+CuSO4ΓζCu(OH)2Γΐ+Na2SO4
ΓΨΫβΈωΓΩ
‘ΧβΔΌΕΰ―θΜ·ΧΦΡή”κ«β―θΜ·ΡΤΖ¥”ΠΘ§Ι A÷–«β―θΜ·ΡΤ»ή“ΚΒΡΉς”Ο «≥ΐ»ΞΕΰ―θΜ·ΧΦΘΜ“Μ―θΜ·ΧΦΒΡΦλ―ι «άϊ”Ο“Μ―θΜ·ΧΦΒΡΜΙ‘≠–‘Θ§“Μ―θΜ·ΧΦΜΙ‘≠―θΜ·Ά≠ –≥ΓΆ≠ΚΆΕΰ―θΜ·ΧΦΘΜ
ΔΎ«βΤχΜΙ‘≠―θΜ·Ά≠…ζ≥…ΒΡ «Ά≠ΚΆΥ°Θ§Ρ«Ο¥÷Μ”–Φλ―ι «Ζώ”–Υ°¥φ‘ΎΦ¥Ω…÷Σ«βΤχΒΡ¥φ‘ΎΘ§Υ°Ω…“‘”ΟΈόΥ°ΝρΥαΆ≠Φλ―ιΘΜ
ΔέΧΦΥαΡΤΜα”κΩ…»ή–‘ΗΤ―ΈΘ®Μρ±Β―ΈΘ©Ζ¥”Π…ζ≥…ΑΉ≥«≥ΝΒμΘ§»γ”ꬻ̷ΗΤΖ¥”Π…ζ≥…ΧΦΥαΗΤΑΉ…Ϊ≥ΝΒμΘΜNaOH»ή“Κ≥ Φν–‘Θ§Ρή ΙΈό…ΪΖ”ΧΣ±δΚλΘΜ«β―θΜ·ΡΤΡޔꬻ̷Ά≠Ζ¥”Π…ζ≥…άΕ…Ϊ≥ΝΒμΓΘ

 ”°‘ΎΩΈΧΟΟϊ ΠΩΈ ±ΦΤΜ°œΒΝ–¥πΑΗ
”°‘ΎΩΈΧΟΟϊ ΠΩΈ ±ΦΤΜ°œΒΝ–¥πΑΗ ΧλΧλœρ…œΩΈ ±Ά§≤Ϋ―ΒΝΖœΒΝ–¥πΑΗ
ΧλΧλœρ…œΩΈ ±Ά§≤Ϋ―ΒΝΖœΒΝ–¥πΑΗ ―τΙβΩΈΧΟΆ§≤ΫΝΖœΑœΒΝ–¥πΑΗ
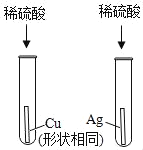
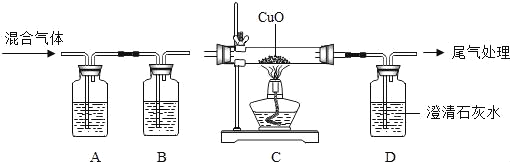
―τΙβΩΈΧΟΆ§≤ΫΝΖœΑœΒΝ–¥πΑΗΓΨΧβΡΩΓΩ»γΆΦΘ§Α―ΫΚΆΖΒΈΙήάοΒΡ“ΚΧεΦΖ»κΉΕ–ΈΤΩΡΎ ±Θ§U–ΈΙή÷–ΒΡΚλΡΪΥ°ΉσΒΆ”“ΗΏΓΘΖ÷Έω“ΚΧεΚΆΙΧΧεΖ÷±π « ≤Ο¥Έο÷ Θ§Χν»κœ¬Οφ±μΗώΡΎΓΘΘ®“Σ«σ–¥≥ω»ΐ÷÷«ιΩωΘ©
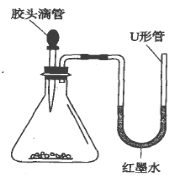
“ΚΧε | ΙΧΧε | |
ΔΌ | _____ | _____ |
ΔΎ | _____ | _____ |
Δέ | _____ | _____ |