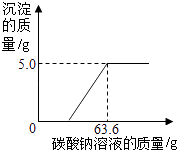
��Ŀ����
����Ŀ��������ͼ��ʾ��ʵ����̺����ṩ�����ݻش����⣮������ǡ����ȫ��Ӧ��C�������ɵ�����ȫ���ݳ��� 
��֪��������Ӧ�Ļ�ѧ����ʽΪNa2CO3+2HCl�T2NaCl+CO2��+H2O
�����ش�
��1��ˮ��H2O�������У��⡢��Ԫ�ص�ԭ�Ӹ�����Ϊ ��
��2����Ӧ����CO2������Ϊg��
��3����������ϡ���������������������Ҫ��д��������̣�
��4����ȡC��Һ10g���Ƴ�20%����Һ�������30%���Ȼ�����Һ���ٿˣ���Ҫ��д��������̣�
���𰸡�
��1��2��1
��2��4.4
��3���⣺��HCl����Ϊx��Na2CO3����Ϊy������NaCl����Ϊz
Na2CO3+ | 2HCl= | 2NaCl+ | CO2��+H2O |
106 | 73 | 117 | 44 |
y | x | z | 4.4g |
![]()
x=7.3g
y=10.6g
z=11.7g
����ϡ�����������������Ϊ�� ![]() =7.3%��
=7.3%��
��ϡ�������������Ϊ7.3%��
��4���⣺�����30%���Ȼ�����Һ����Ϊw
15�˻������NaCl����Ϊ15��10.6=4.4g ��Ӧ���ɵ�NaCl����Ϊ11.7g
C��NaCl��������
�� ![]()
��10��10%+w��30%=��10+w����20%
w=10g
�������30%���Ȼ�����Һ����Ϊ10g��
���������⣺��1��ˮ��H2O�������У��⡢��Ԫ�ص�ԭ�Ӹ�����Ϊ2��1����2����Ӧ����CO2������Ϊ15g+50.4g+100g��161g=4.4g��
�����㾫����������Ҫ�����˸��ݻ�ѧ��Ӧ����ʽ�ļ�������֪ʶ�㣬��Ҫ���ո����ʼ�������=ϵ������Է�������֮�Ȳ�����ȷ�����⣮

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�