题目内容
【题目】彩漂洗衣液能够去渍、除菌,白色和彩色织物均可使用。彩漂洗衣液中含有过氧化氢。实验小组对过氧化氢的某些性质进行探究。
Ⅰ.不稳定性
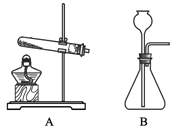
(1)过氧化氢易分解。实验室用其制取氧气时,所选用的发生装置为_____(填字母序号)。
(2)6.8g过氧化氢全部分解产生O2的质量为_____g。
Ⅱ.漂白性
(查阅资料)过氧化氢溶液可漂白一些有色物质。

(进行实验)
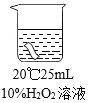
实验1:室温下用10%的过氧化氢溶液浸泡一块红色布条,浸泡时间与布条颜色变化如下表。
浸泡时间 | 20min | 40min | 60min |
布条颜色的变化 | 无明显变化 | 颜色稍变浅 | 颜色明显变浅 |
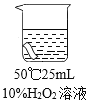
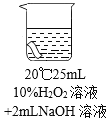
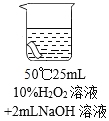
实验2:将红色布条分别浸泡在4种溶液中,现象如下表。
编号 | ① | ② | ③ | ④ |
实验 |
|
|
|
|
布条颜色 | 无明显变化 | 颜色稍变浅 | 颜色稍变浅 | 颜色明显变浅 |
(解释与结论)
(3)实验1的目的是_____。
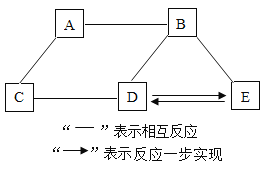
(4)实验2中,欲得出“其他条件相同时,升高温度可使过氧化溶液的漂白性增强”的结论,需要对比实验_____(填编号)。
(5)实验2中,通过对比②③④,得出的结论是_____。
(6)根据上述实验,推测“使用彩漂液时水温不宜超过50℃”的原因是_____。
【答案】B 3.2 探究浸泡时间对H2O2溶液漂白效果的影响 ①②(或③④) 其他条件相同时,升高温度并且加入氢氧化钠溶液,可使H2O2溶液的漂白性显著增强 温度超过50℃,过氧化氢对织物上有色物质的漂白性会增强,从而导致衣服褪色
【解析】
解:Ⅰ.(1)过氧化氢易分解,实验室用其制取氧气时,是固液常温型反应,故所选用的发生装置为B;
(2)设6.8g过氧化氢全部分解产生O2的质量为x,
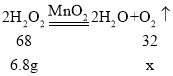
![]()
x=3.2g;
Ⅱ.[解释与结论](3)实验1是为了探究浸泡时间对H2O2溶液漂白效果的影响;
(4)实验2中,欲得出“其他条件相同时,升高温度可使过氧化氢溶液的漂白性增强”的结论,可以对比实验 ①②(或③④);
(5)实验2中,通过对比②③④,可以看出其他条件相同时,升高温度并且加入氢氧化钠溶液,可使H2O2溶液的漂白性显著增强。
(6)“使用彩漂液时水温不宜超过50℃”是因为当温度超过50℃,过氧化氢对织物上有色物质的漂白性会增强,从而导致衣服褪色。

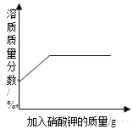
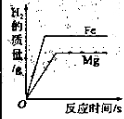
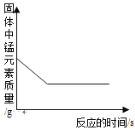
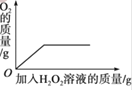
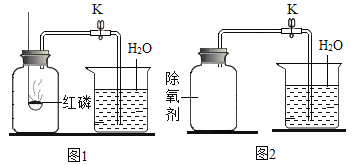
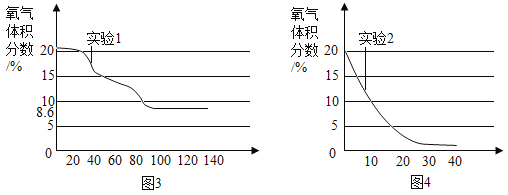
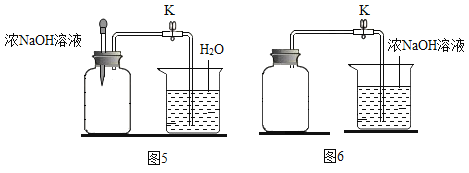
【题目】下列图像能正确反映对应变化关系的是( )
|
|
|
|
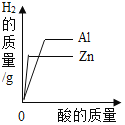
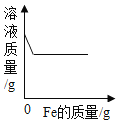
A.20℃时,向一定量的硝酸钾不饱和溶液中加入硝酸钾固体 | B.将等质量的镁片和铁片投入到足量稀硫酸中 | C.用酒精灯加热一定量的高锰酸钾固体 | D.向盛有少量二氧化锰的烧杯中不断地加入过氧化氢溶液 |
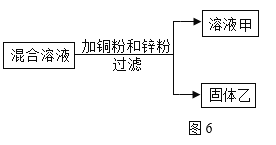
【题目】某校实验室有一瓶久置的铁屑,其成分是铁、氧化铁和水。为测定其中各成分的质量分数,某兴趣小组按下图所示装置进行实验(装置气密性良好;固定装置已略去;氮气不与铁屑中的成分反应;碱石灰是氧化钙和氢氧化钠的混合物)。
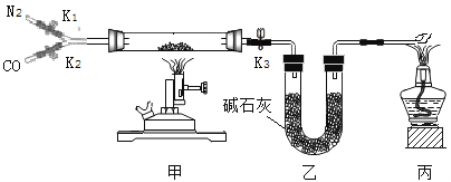
部分实验步骤如下:
Ⅰ.称量硬质玻璃管的质量。将样品放入硬质玻璃管中,称量硬质玻璃管和样品的质量。
II.连接好装置。缓缓通入N2,点燃甲处的酒精喷灯,待硬质玻璃管中固体恒重,记录硬质玻璃管和剩余固体的质量。
Ⅲ.再次连接好装置,继续实验。通入CO,点燃丙处的酒精灯和甲处的酒精喷灯。待硬质玻璃管中固体恒重,熄灭酒精喷灯,继续通入CO直至硬质玻璃管冷却。再次记录硬质玻璃管和剩余固体的质量。
实验数据记录如下表:
硬质玻璃管 | 硬质玻璃管和样品 | 步骤II硬质玻璃 管和剩余固体 | 步骤步骤Ⅲ硬质玻璃 管和剩余固体 | |
质量 | m1 | m2 | m3 | m4 |
请回答下列问题:
(1)步骤Ⅲ丙处酒精灯的作用是____________。
(2)步骤Ⅲ硬质玻璃管中反应的化学方程式为________。
(3)样品中氧化铁的质量分数为_____(用m1、m2、m3、m4的代数式表示)。若步骤Ⅲ中氧化铁没有完全反应,样品中水的质量分数测量结果将______(填“偏大”“偏小”或“不变”)。
(4)有关样品,下列说法正确的是_____(填字母标号)。
A样品中氢元素的质量为1/9(m2-m3) B样品中铁单质和氧化铁的质量总和为m3-m1
C样品中铁单质的质量为m4-m1 D样品中氧元素的质量为m3-m4