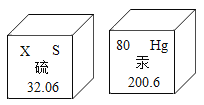
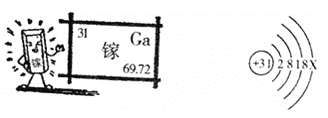
题目内容
【题目】“检测草木灰浸出液的酸碱性”实验操作如下,其中不正确的是
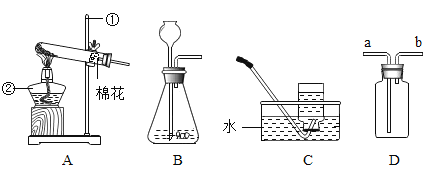
A.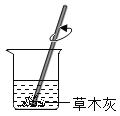 草木灰加水搅拌B.
草木灰加水搅拌B.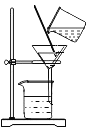 过滤
过滤
C.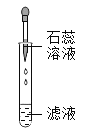 检验酸碱性D.
检验酸碱性D.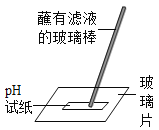 测定酸碱度
测定酸碱度
【答案】C
【解析】
A、根据溶解操作的方法,进行分析判断;
B、过滤液体时,注意“一贴、二低、三靠”的原则;
C、根据使用胶头滴管滴加少量液体的方法进行分析判断;
D、根据用pH试纸测定未知溶液的pH的方法进行分析判断。
A、溶解时,溶解操作应在烧杯中进行,用玻璃棒不断搅拌,图中所示操作正确,不符合题意;
B、过滤液体时,要注意“一贴、二低、三靠”的原则,图中所示操作正确,不符合题意;
C、使用胶头滴管滴加少量液体的操作,注意胶头滴管不能伸入到试管内或接触试管内壁,应垂直悬空在试管口上方滴加液体,防止污染胶头滴管,图中所示操作错误,符合题意;
D、用pH试纸测定未知溶液的pH时,正确的操作方法为取一片pH试纸放在玻璃片或白瓷板上,用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH,图中所示操作正确,不符合题意;
故选:C。

【题目】用砂纸打磨过的镁条加入盛有稀盐酸的试管中,产生大量气泡,且试管发热。在分组实验中,部分小组的同学发现:试管中出现白色不溶物。
[提出问题一]为什么有的小组会出现白色不溶物?
[实验探究一]在4支试管中分别加入相同质量、相同溶质质量分数的稀盐酸,形状大小相同、用砂纸打磨过的镁条,实验记录如表:
镁条的长度/cm | 1 | 2 | 3 | 4 |
不溶物 | 无 | 少量 | 较多 | 很多 |
[实验结论]通过上表可知,出现白色不溶物与___有关,由此你对化学反应有什么新的认识___。
[提出问题]白色不溶物是什么?
[查阅资料]①AgNO3与可溶性氯化物反应,生成不溶于水,也不与稀硝酸反应的白色沉淀。②Mg(OH)2和Mg(OH)Cl均为白色固体,不溶于水但能与稀盐酸、稀硫酸等反应生成盐和水。
[提出猜想]
猜想l:是没有参加反应的镁条;
猜想2:是生成的MgCl2过多而析出晶体
猜想3:是生成的Mg(OH)2白色沉淀;
猜想4:是生成的Mg(OH)Cl白色沉淀。
[实验探究]
将上述试管反应后的物质过滤,并将得到的白色不溶物分成三份,分别放入三支试管中进行实验。
实验序号 | 实验操作 | 实验现象 | 实验结论 |
实验1 | 滴加适量稀盐酸。 | _____。 | 猜想1不成立 |
实验2 | 加入适量蒸馏水,充分振荡 | 白色不溶物没有减少 | 猜想2不成立 |
实验3 | ①滴入足量的稀硝酸 ②再向①中继续滴入足量的硝酸银溶液 | _____。 | 白色不溶物一定含有氯元素,说明猜想3不成立,猜想4成立 |
[实验反思]
①甲同学对上述实验3的结论提出质疑,他认为实验3设计不严密,要验证猜想4是否成立,在进行实验3之前应该进行的操作是______。
②在老师的指导下,实验小组最终确定白色不溶物是Mg(OH)Cl,请写出Mg(OH)Cl与稀盐酸反应的化学方程式_____。
【题目】小华同学无意将NaOH溶液与NaHCO3溶液混合,发现无明显现象。对此他产生疑问:两种物质是否发生了化学反应?在老师的帮助下,他进行了以下探究。

(查阅资料)NaHCO3溶液能与NaOH溶液反应生成一种新盐和一种常见的液体氧化物。
NaHCO3在50℃开始分解。
(实验探究)用一定溶质的质量分数的NaHCO3、NaOH和Na2CO3三种溶液进行如下实验,为设计实验方案提供参考。
NaHCO3溶液 | NaOH溶液 | Na2CO3溶液 | |
加入稀盐酸 | 现象Ⅰ | 无明显变化 | 产生气泡 |
加入澄清石灰水 | 溶液变浑浊 | 无明显变化 | 现象Ⅱ |
加入CaCl2稀溶液 | 无明显变化 | 溶液变浑浊 | 溶液变浑浊 |
加热溶液至沸腾,将 气体通入澄清石灰水 | 澄清石灰水 变浑浊 | 澄清石灰水 无明显变化 | 澄清石灰水 无明显变化 |
(1)表中的现象Ⅰ为_____,发生现象Ⅱ对应反应的化学方程式为_____。
实验过程
(实验探究)证明反应生成了新盐
(2)NaHCO3溶液能与NaOH溶液反应生成新的盐是_____(填物质名称)。同学们选用上表实验中的药品,设计了如图所示实验,先在NaHCO3 溶液中加入A溶液,无明显现象,再滴加NaOH溶液,溶液变浑浊,则A溶液是_____。
(3)有同学提出上述实验方案有问题,其理由是_____。为了达到实验目的,你需要继续进行的操作是_____。
(交流反思)证明反应后NaHCO3不存在
(4)同学们参考上表中的实验,又设计了一个实验,虽然没有观察到明显的实验现象,但可以证明反应发生了,你的实验方案是_____。