题目内容
 小明同学将12.5g含杂质的石灰石样品与100g足量的稀盐酸相混合(石灰石中的杂质不参加反应),充分反应,测得反应生成气体的质量(m)与反应时间(t)的数据如下表所示
小明同学将12.5g含杂质的石灰石样品与100g足量的稀盐酸相混合(石灰石中的杂质不参加反应),充分反应,测得反应生成气体的质量(m)与反应时间(t)的数据如下表所示| 反应时间t/s | t0 | t1 | t2 | t3 | t4 | t5 | t6 |
| 气体质量m/g | 0 | 0.88 | 1.76 | 2.64 | 3.52 | 4.4 | 4.4 |
(1)碳酸钙完全反应后,生成CO2的质量为
4.4
4.4
g.(2)请在右面的坐标图中,画出反应时生成的气体的质量(m)随时间(t)变化的曲线;
(3)计算石灰石样品中碳酸钙的质量分数为多少?(写出具体的解题步骤)
分析:(1)由表中数据可知,完全反应后生成二氧化碳的质量是4.4g;
(2)根据提供的数据可以绘制反应时生成二氧化碳的质量(m)随时间(t)变化的曲线;
(3)已知二氧化碳的质量,根据化学方程式可以计算碳酸钙的质量,进一步可以计算碳酸钙的质量分数.
(2)根据提供的数据可以绘制反应时生成二氧化碳的质量(m)随时间(t)变化的曲线;
(3)已知二氧化碳的质量,根据化学方程式可以计算碳酸钙的质量,进一步可以计算碳酸钙的质量分数.
解答:解:(1)由表中数据可知,当时间进行到t5时,二氧化碳的质量不再增大,说明碳酸钙已经完全反应,生成二氧化碳的质量是4.4g.
故填:4.4;
(2)由反应生成二氧化碳的质量和反应时间的关系,绘制的反应时生成的二氧化碳质量(m)随时间(t)变化的曲线如下图所示:
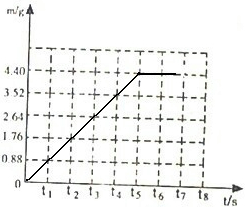
(3)解:设碳酸钙的质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 44
x 4.4g
=
,
x=10g,
石灰石样品中碳酸钙的质量分数为:
×100%=80%;
答:石灰石样品中碳酸钙的质量分数为80%.
故填:4.4;
(2)由反应生成二氧化碳的质量和反应时间的关系,绘制的反应时生成的二氧化碳质量(m)随时间(t)变化的曲线如下图所示:

(3)解:设碳酸钙的质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 44
x 4.4g
| 100 |
| 44 |
| x |
| 4.4g |
x=10g,
石灰石样品中碳酸钙的质量分数为:
| 10g |
| 12.5g |
答:石灰石样品中碳酸钙的质量分数为80%.
点评:本题主要考查绘图和根据化学方程式进行计算两方面的能力,书写化学方程式时要注意配平.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
 (2012?静安区一模)鸡蛋壳的主要成分是碳酸钙,小明同学为了测定鸡蛋壳中碳酸钙的质量分数,进行了如下的探究实验,请你参与他的活动.
(2012?静安区一模)鸡蛋壳的主要成分是碳酸钙,小明同学为了测定鸡蛋壳中碳酸钙的质量分数,进行了如下的探究实验,请你参与他的活动.
 剩余的混合物48.6g
剩余的混合物48.6g 程式计算鸡蛋壳中含碳酸钙的物质的量解题过程: (26)
程式计算鸡蛋壳中含碳酸钙的物质的量解题过程: (26) 
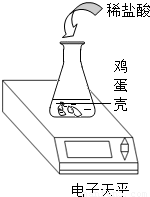 鸡蛋壳的主要成分是碳酸钙,小明同学为了测定鸡蛋壳中碳酸钙的质量分数,进行了如下的探究实验,请你参与他的活动.
鸡蛋壳的主要成分是碳酸钙,小明同学为了测定鸡蛋壳中碳酸钙的质量分数,进行了如下的探究实验,请你参与他的活动.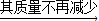 剩余的混合物48.6g
剩余的混合物48.6g