题目内容
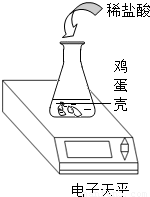 鸡蛋壳的主要成分是碳酸钙,小明同学为了测定鸡蛋壳中碳酸钙的质量分数,进行了如下的探究实验,请你参与他的活动.
鸡蛋壳的主要成分是碳酸钙,小明同学为了测定鸡蛋壳中碳酸钙的质量分数,进行了如下的探究实验,请你参与他的活动.将鸡蛋壳洗净、干燥、称量并捣碎后放入到锥形瓶中,加入足量的稀盐酸充分反应(假设其他杂质不与盐酸反应,反应生成的气体全部逸出).
鸡蛋壳12.5g+稀盐酸40.5g
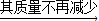 剩余的混合物48.6g
剩余的混合物48.6g①根据质量守恒定律,计算反应生成二氧化碳的质量为______g.
②通过化学方程式计算鸡蛋壳中含碳酸钙的物质的量解题过程;
③计算鸡蛋壳中碳酸钙的质量分数.
解题过程:______;
实验中,如有部分生成的二氧化碳气体因溶解于水而没有全部逸出,造成计算结果与实际值相比______(填写“偏大”、“偏小”或“不变”).
【答案】分析:根据鸡蛋壳的主要成分是碳酸钙和碳酸钙的性质可知,加入稀盐酸时,碳酸钙与稀盐酸反应生成了氯化钙、水和二氧化碳;根据质量守恒定律,锥形瓶内质量的减少的质量即生成的二氧化碳的质量,据此根据反应的化学方程式列式计算出参加反应碳酸钙的质量,进而计算出碳酸钙的质量分数.
解答:解:①根据质量守恒定律,生成二氧化碳的质量为12.5g+40.5g-48.6g=4.4g.
②设鸡蛋壳中含碳酸钙的物质的量为x,4.4g二氧化碳的物质的量为4.4g÷4.4g/mol=0.1mol,
CaCO3+2HCl═CaCl2+H2O+CO2↑
1 1
x 0.1mol
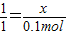 x=0.1mol
x=0.1mol
③鸡蛋壳中碳酸钙的质量分数为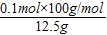 ×100%=80%.
×100%=80%.
如有部分生成的二氧化碳气体因溶解于水而没有全部逸出,会造成计算出的碳酸钙的质量偏小,则造成计算结果与实际值相比偏小.
故答案为:①4.4g;②鸡蛋壳中含碳酸钙的物质的量为0.1mol;鸡蛋壳中碳酸钙的质量分数为80%;③偏小.
点评:本题难度不大,掌握根据化学方程式的计算即可正确解答本题,根据质量守恒定律计算出二氧化碳的质量是正确解答本题的前提和关键.
解答:解:①根据质量守恒定律,生成二氧化碳的质量为12.5g+40.5g-48.6g=4.4g.
②设鸡蛋壳中含碳酸钙的物质的量为x,4.4g二氧化碳的物质的量为4.4g÷4.4g/mol=0.1mol,
CaCO3+2HCl═CaCl2+H2O+CO2↑
1 1
x 0.1mol
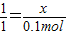 x=0.1mol
x=0.1mol③鸡蛋壳中碳酸钙的质量分数为
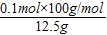 ×100%=80%.
×100%=80%.如有部分生成的二氧化碳气体因溶解于水而没有全部逸出,会造成计算出的碳酸钙的质量偏小,则造成计算结果与实际值相比偏小.
故答案为:①4.4g;②鸡蛋壳中含碳酸钙的物质的量为0.1mol;鸡蛋壳中碳酸钙的质量分数为80%;③偏小.
点评:本题难度不大,掌握根据化学方程式的计算即可正确解答本题,根据质量守恒定律计算出二氧化碳的质量是正确解答本题的前提和关键.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案
相关题目