题目内容
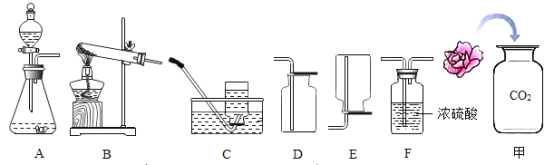
【题目】如图所示为实验室中常见的气体制备、净化、收集和性质实验的部分仪器.请按要求回答:
(1)以石灰石和稀盐酸为原料,在实验室中制备二氧化碳,并研究其有关性质,请回答:
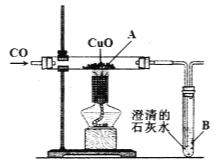
①欲制备、收集一瓶干燥的CO2,所选仪器的连接顺序为_____→_____→_____(填序号).
②检验CO2收集满的方法是将_____放在_____,如果看到木条熄灭,则证明CO2已收集满.
③将少量的CO2气体通入盛有大量澄清石灰水的烧杯中,观察到石灰水_____,有关反应的化学方程式_____;烧杯中溶液的质量与之前相比会_____(填序号).
A 增大 B 减小 C 不变 D 无法判断
④取一朵用石蕊溶液染成紫色的干燥小花,将小花的一半用水喷湿,放入装置甲中,可观察到的实验现象是_____,此现象说明CO2具有的化学性质是_____(可用相关反应的化学方程式表示).
(2)常温下,氨气是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水,其水溶液呈碱性.实验室常用氯化铵固体和碱石灰固体加热来制取氨气(NH3),反应方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
①实验室制取并收集氨气,应该选择的发生装置是_____(填写仪器序号,下同),收集装置是_____.
②将氨气通入水中,用pH试纸粗略测定氨水溶液的酸碱性强弱,请简述测定方法:_____.
【答案】A F D 燃着的木条 集气瓶口 变浑浊 CO2+Ca(OH)2=CaCO3↓+H2O B 小花喷水的一半变红,未喷水的一半不变色 CO2+H2O═H2CO3 B E 用玻璃棒蘸取氨水,涂抹在pH试纸上,将显示的颜色与标准比色卡对照,即可知道氨水的pH
【解析】
(1)①欲制备、收集一瓶干燥的CO2,使用的是石灰石和稀盐酸反应,是固—液常温型反应,故选择A装置制取,干燥二氧化碳使用浓硫酸,二氧化碳可溶于水且密度比空气大,收集二氧化碳使用向上排空气法,故所选仪器的连接顺序为A→F→D;
②检验CO2收集满的方法是使用燃着的木条,将燃着的木条放在集气瓶口,如果看到木条熄灭,则证明CO2已收集满;
③将少量的CO2气体通入盛有大量澄清石灰水的烧杯中,二氧化碳能与氢氧化钙反应生成碳酸钙沉淀,故观察到石灰水变浑浊,有关反应的化学方程式 CO2+Ca(OH)2=CaCO3↓+H2O;由于吸收二氧化碳的质量小于生成沉淀的质量,故烧杯中溶液的质量与之前相比会减小,故选B;
④取一朵用石蕊溶液染成紫色的干燥小花,将小花的一半用水喷湿,放入装置甲中,可观察到的实验现象是喷水的一半变红,未喷水的一半不变色,此现象说明CO2能与水反应生成碳酸,反应的化学方程式为:CO2+H2O═H2CO3;
(2)①实验室制取并收集氨气,是固体加热型反应,应该选择的发生装置是B,氨气能溶于水且密度比空气小,故收集装置是E;
②将氨气通入水中,用pH试纸粗略测定氨水溶液的酸碱性强弱,测定方法是用玻璃棒蘸取氨水,涂抹在pH试纸上,将显示的颜色与标准比色卡对照,即可知道氨水的pH,故填:用玻璃棒蘸取氨水,涂抹在pH试纸上,将显示的颜色与标准比色卡对照,即可知道氨水的pH。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某研究学习小组欲测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品20 g,把80 g稀盐酸分四次加入,实验过程所得数据如下表(已知石灰石样品中含有的二氧化硅等杂质不溶于水,也不与稀盐酸反应)。
实验次数 | 加入稀盐酸的质量/g | 剩余固体的质量/g |
1 | 20 | 15 |
2 | 20 | 10 |
3 | 20 | 6.8 |
4 | 20 | n |
根据实验数据计算:
(1)表中n的数值为_____。
(2)样品中碳酸钙的质量分数是_____。
(3)计算样品中碳酸钙完全反应时产生二氧化碳的质量_____。(结果精确到0.1 g)