题目内容
【题目】铭铭同学想通过实验来证明四氧化三铁可以作过氧化氢分解的催化剂这一个命题。
(1)请你帮助铭铭同学完成下列表格所示的探究实验:
实验操作 | 实验现象 | 实验结论 | 实验总结 | |
步骤一 | 取5mL5%的过氧化氢溶液于试管中,插入带火星的木条 | 有少量气泡产生,木条不复燃 | 过氧化氢分解产生氧气,但是_______ | 四氧化三铁是过氧化氢分解的催化剂 |
步骤二 | 取5mL5%的过氧化氢溶液于试管中,向其中加入 ______,插入带火星的木条 | ___________,木条复燃 | 四氧化三铁能加快过氧化氢的分解 |
(2)写出步骤二中发生的反应的文字表达式 ___________
(3)小强同学认为仅由上述实验还不能完全得出表内的总结,他还补充设计了两个方面的探究实验,最终才完成了对该命题的实验证明。
第一方面的实验操作中包含了两次称量,其目的是 ______;
第二方面的实验是利用“步骤二”反应后的固体剩余物继续实验,接下来的实验操作是 ______。
(4)小强在进行实验时候发现试管内有许多水雾,由此推断过氧化氢分解是______反应(填“吸热”或“放热”)。
(5)小强还发现将过氧化氢溶液加入盛有四氧化三铁的试管后,反应速率先是逐渐加快,然后又逐渐变慢(如图所示)
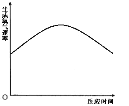
从影响化学反应速率的因素来分析过氧化氢分解速率发生变化的原因是:
①反应速率先变快的原因:________;
②反应速率后变慢的原因:_________。
【答案】反应速度慢,产生氧气少 四氧化三铁 有大量气泡产生,带火星的木条迅速复燃 ![]() 比较四氧化三铁反应前后质量是否变化 倾倒掉反应后的液体,向剩余的固体中重新加人过氧化氢溶液 放热 反应放热能加快反应 随着反应的进行过氧化氢浓度降低,反应逐渐减慢
比较四氧化三铁反应前后质量是否变化 倾倒掉反应后的液体,向剩余的固体中重新加人过氧化氢溶液 放热 反应放热能加快反应 随着反应的进行过氧化氢浓度降低,反应逐渐减慢
【解析】
解:(1)催化剂的作用是加快了反应的速度,并不能使不反应的物质发生反应,所以,步骤一中,过氧化氢也会分解只是速度慢;步骤二中,只要向盛有5%过氧化氢溶液的试管中加入四氧化三铁,将带火星的木条伸入试管,如果有大量气泡产生,带火星的木条迅速复燃,说明了四氧化三铁加快了过氧化氢的分解速度;
(2)过氧化氢在四氧化三铁的催化作用下生成水和氧气,反应的文字表达式为:![]() ;
;
(3)为了说明四氧化三铁在此实验中反应前后的质量保持不变,做了两次称量,目的是比较四氧化三铁反应前后质量是否变化,并且在验证四氧化三铁的化学性质是否改变时,将剩余的固体中再倒入过氧化氢溶液,发现过氧化氢溶液又能很快的放出氧气;
(4)在进行实验时,发现试管内有许多水蒸气,由此推断过氧化氢分解是放热反应;
(5)过氧化氢分解的速率先增大后减小,其原因反应放热能加快反应,随着反应的进行过氧化氢浓度降低,反应逐渐减慢。

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
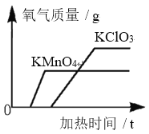
名校联盟快乐课堂系列答案【题目】某兴趣小组同学探究影响双氧水分解速度的因素和验证质量守恒定律实验,数据记录如下:
双氧水的质量 | 双氧水的浓度 | 催化剂及质量 | 相同时间内产生O2体积 | |
Ⅰ | 50.0g | 1% | MnO2 0.1g | 9 mL |
Ⅱ | 50.0g | 2% | CuO 0.1g | 12 mL |
Ⅲ | 50.0g | 2% | MnO2 0.1g | 16 mL |
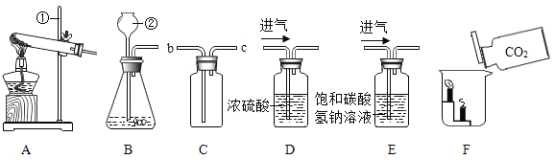
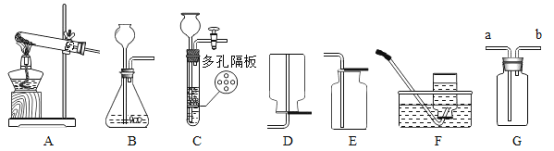
(1)本实验中,小李同学测量O2的体积可选择甲图中的___________(填编号)装置。
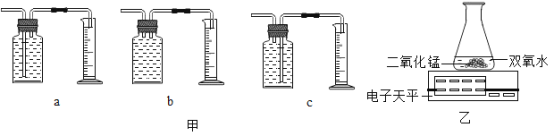
(2)通过实验_________(从“Ⅰ”“Ⅱ”“Ⅲ”中选填),小李得出结论:双氧水的浓度越大,分解速度越快;你认为根据实验记录的数据该小组同学还能得到______结论。
(3)小王同学用乙图装置进行实验,反应的化学方程式为_______;该反应属于________(填基本反应类型)。他通过比较_______,也得出了“双氧水浓度越大反应速度越快”的实验结论。
(4)小张同学看到电子天平数据比混合之前数据减小了,他认为该反应不遵守质量守恒定律。你认为他的看法_______(填正确或错误),原因是__________。