题目内容
【题目】童童同学在实验室中进行了如下实验。她先向盛有氢氧化钡溶液的烧杯中注入一定量的氯化铜溶液,再向其中注入一定量的硫酸钾溶液,过滤,得滤渣和滤液A,如图所示:
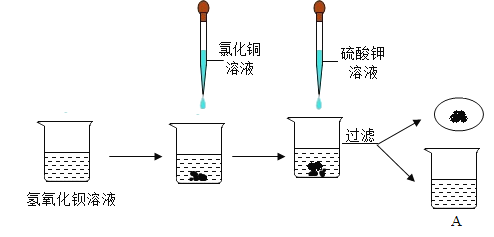
此过程中观察到的现象是_____;充分反应后过滤,得到无色溶液A,童童同学对无色溶液A产生了浓厚的兴趣,进行了进一步的探究活动。
[提出问题]:A中含有的离子是什么?
[实验探究]:
童童同学:取少量A溶液于试管中滴加硝酸钡溶液,观察到无明显现象,故得出结论:A中不含SO42-,含Ba2+。
希溪同学:取少量A溶液于试管中滴加硫酸镁溶液,观察到溶液中产生白色沉淀,故得出结论:A中含Ba2+、OH-。
[评价与交流]:请你评价希溪同学实验得出的结论_____。
[实验探究]:为了进一步确定A中的离子成分,婷婷同学取少量A溶液于试管中滴加稀硫酸,观察到溶液中产生白色沉淀。再另取A溶液,向其中滴加无色酚酞溶液,观察到无色酚酞溶液变为红色。
[实验结论]:结合上述实验及综合分析最终确定A中含有的离子是_____(填离子符号),不含有的离子是_____(填离子符号);
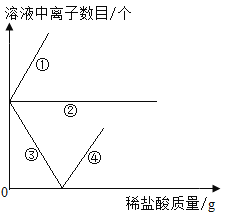
为了除去A溶液中的碱性物质,童童同学又向A溶液中加入了一定量的稀盐酸,在加入稀盐酸的过程中,A溶液中离子的变化情况如所示,①和④分别表示的_____(填离子符号);
[归纳与总结]由三位同学实验对比得出,确定溶液中可能存在的不同离子是否存在的方法是:可根据待测离子与所加试剂反应_____,确定出存在的离子,同时推测出与_____。
【答案】溶液中先产生蓝色沉淀,后产生白色沉淀 不正确,在溶液中硫酸根离子能与钡离子反应生成硫酸钡白色沉淀,镁离子能与氢氧根离子反应生成氢氧化镁白色沉淀,加入硫酸镁溶液产生白色沉淀,说明溶液中含有钡离子和氢氧根离子中的一种或两种,不能证明一定同时有钡离子和氢氧根离子,所以不正确(或不正确,若溶液中的离子是钾离子、氯离子和钡离子,加入硫酸镁溶液,在溶液中钡离子和硫酸根离子反应生成硫酸钡,也产生白色沉淀,所以不正确)(合理即可) K+、Cl-、Ba2+、OH- Cu2+、SO42- CI-、H+ 产生不同的明显的实验现象或产生独特的明显的实验现象 确定存在的离子能反应的离子不存在(其他答法合理即可)
【解析】
氢氧化钡溶液与氯化铜反应产生氢氧化铜沉淀和氯化钡溶液,氢氧化钡溶液与硫酸钾反应产生硫酸钡沉淀和氢氧化钾溶液,此过程中观察到的现象是:溶液中先产生蓝色沉淀,后产生白色沉淀;
评价与交流:希溪同学实验得出的结论:不正确,在溶液中硫酸根离子能与钡离子反应生成硫酸钡白色沉淀,镁离子能与氢氧根离子反应生成氢氧化镁白色沉淀,加入硫酸镁溶液产生白色沉淀,说明溶液中含有钡离子和氢氧根离子中的一种或两种,不能证明一定同时有钡离子和氢氧根离子,所以不正确;
实验探究:为了进一步确定A中的离子成分,婷婷同学取少量A溶液于试管中滴加稀硫酸,观察到溶液中产生白色沉淀(硫酸根与钡离子反应产生硫酸钡沉淀),说明溶液中含有钡离子,一定没有硫酸根。再另取A溶液,向其中滴加无色酚酞溶液,观察到无色酚酞溶液变为红色,说明溶液显碱性,含有氢氧根离子。原溶液为无色,则一定不含铜离子(蓝色);
[实验结论]:氢氧化钡溶液先后加入氯化铜和硫酸钾分别产生氯化钡溶液和氢氧化钾溶液,结合上述实验及综合分析最终确定A中含有的离子是:K+、Cl-、Ba2+、OH-;不含有的离子是:Cu2+、SO42-;
为了除去A溶液中的碱性物质,童童同学又向A溶液中加入了一定量的稀盐酸,在加入稀盐酸的过程中,引入氢离子和氯离子,氯离子不参加反应,氢氧根与氢离子反应产生水,①表示氯离子数目,随着稀盐酸的加入不断增大;④表示氢离子先与氢氧根反应,待反应完全后,氢离子过量,氢离子数目随着稀盐酸的加入不断增大。

 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案【题目】请从A或B两题中任选一个作答,若两题均作答,按A计分。
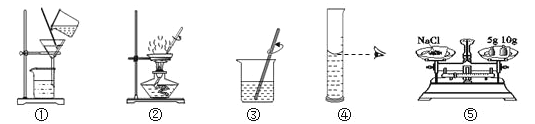
A 配制160g 10%的氯化钠溶液 | B去除粗盐中的泥沙 |
(1)实验的主要步骤是:⑤→_____→③。 (2)溶解时,用玻璃棒搅拌的目的是_____。 | (1)实验的主要步骤是:③→_____→②。 (2)蒸发时,用玻璃棒搅拌的目的是_____。 |
可供选择的基本实验操作如图:
| |