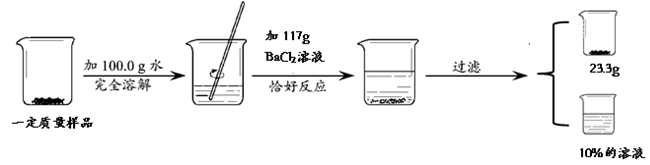
题目内容
(3分)将Na2CO3和NaCl固体混合物32.9g放入烧杯中,此时总质量为202.9g,加入326.9g盐酸,恰好完全反应,待没有气泡逸出后再次称量,总质量为521.0g。计算所得溶液中溶质的质量分数(CO2的溶解忽略不计)。
10
解析试题分析:首先根据质量守恒定律:化学反应前后,物质的质量不变,可先求出产生的气体二氧化碳的质量=202.9g+326.9g-521.0g=8.8g,再根据化学反应方程式:Na2CO3+2HCl==2NaCl+H2O+CO2↑可知,反应后所得溶液中溶质是NaCl,但NaCl来自两部分,一是反应生成的,二是原固体混合物中含有的,生成的NaCl可通过化学方程式来求解,原固体混合物中含有的NaCl可通过混合物32.9g减去Na2CO3的质量
解:反应生成的CO2质量=202.9g+326.9g-521.0g=8.8g
设Na2CO3的质量为x,生成的NaCl的质量为y。
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117 44
x y 8.8g
x=21.2g y=23.4g
所得溶液中溶质的质量分数=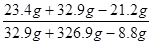 ×100%=10%
×100%=10%
答:所得溶液中溶质的质量分数为10%。
考点:根据化学方程式进行的计算

练习册系列答案
相关题目