题目内容
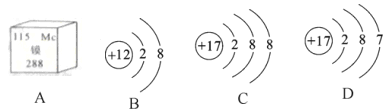
【题目】请回答下列与金属有关的问题。
(1)铜片与黄铜片相互刻画,在__________片表面会留下划痕:
(2)炼铁核心反应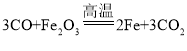 ,__________发生了还原反应;
,__________发生了还原反应;
(3)向AgNO3和Cu(NO3)2的混合溶液里加入一定的Zn粉,充分反应后过滤,得到无色滤液,则滤渣中一定含有的金属是______________。
【答案】铜 氧化铁(或Fe2O3) 银、铜
【解析】
(1)一般情况下,合金的硬度大于其组成的纯金属,因此铜片与黄铜片相互刻画,在铜片表面会留下痕迹;
(2)炼铁反应中,一氧化碳与氧化铁反应生成铁和二氧化碳,一氧化碳具有还原性,把氧化铁中的氧元素夺走,还原成铁单质,因此氧化铁发生还原反应;
(3)向AgNO3和Cu(NO3)2的混合溶液里加入一定的Zn粉,锌先置换硝酸银中的银,后置换硝酸铜中的铜,因为充分反应后过滤,得到无色滤液,说明硝酸铜已反应完,因此置换出的金属一定含有银、铜。

 ABC考王全优卷系列答案
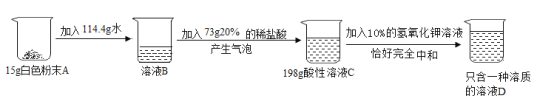
ABC考王全优卷系列答案【题目】化学小组同学在帮实验员整理药品时,发现一瓶标签残缺的无色溶液(如图1所示),为确定其中溶质的成分,进行了如下探究活动。
(做出猜想)
根据标签内容,推测溶质可能为NaOH、NaCl、Na2SO4、NaNO3、Na2CO3、 NaHCO3中的一种。
(查阅资料)上述六种物质的相关信息如表:
物质 | NaOH | NaCl | Na2SO4 | NaNO3 | Na2CO3 | NaHCO3 |
常温下的溶解度/g | 109 | 36 | 19.5 | 87 | 21.5 | 9.6 |
水溶液的酸碱性 | 碱性 | 中性 | 中性 | 中性 | 碱性 | 碱性 |
(分析讨论)小组同学一致认为,溶液中的溶质不可能是 NaHCO3,其理由是___________。
(实验探究)小组同学对其余五种猜想继续进行探究。
实验操作 | 测定结果或现象 | 得出结论 |
取少量待测液于试管中,测溶液的pH | PH>7 | 溶质不可能是______ |
取少量待测液于试管中,加入2mL稀盐酸 | 观察到_______ | 溶质是碳酸钠 |
(反思交流)
小红结合药品的存放环境进行分析,认为溶液中的碳酸钠还有可能是氬氧化钠变质产生的,其变质的化学方程式为__________。因,溶液中的溶质可能有两种情况:第一种情况是只含Na2CO3:第二种情况是含有________。
(进一步探究)

为最后确定溶液中溶质的成分,小组同学按如图2所示过程进行实验(已知CaCl2溶液呈中性),步骤③中观察到溶液为________色,因此确认第二种情况成立。
(总结提高)
倾倒液体药品时,为防止标签损坏,应注意 _______,且药品取用完毕后应及时盖好瓶塞。