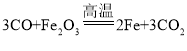题目内容
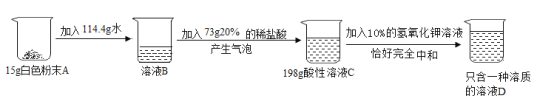
【题目】实验室有一包白色粉末,设计实验初步证明白色粉末A的成分都是钾盐(且不含氢元素)。有关数据如下图所示:
(1)写出题中产生气泡的反应方程式______。
(2)根据已知条件列出A中参加反应的固体质量(x)的比例式_______。
(3)白色粉末A中参加反应的物质含量为________。
(4)C溶液中溶质成分的化学式为______且质量分别为______。
(5)计算所得D溶液中溶质的质量分数为_______。
【答案】![]()
![]() 13.8g KCl、HCl 16.1g、7.3g 10%
13.8g KCl、HCl 16.1g、7.3g 10%
【解析】
(1)白色粉末A的成分都是钾盐,加入稀盐酸产生气泡,所以白色粉末A中含碳酸钾,碳酸钾和稀盐酸反应生成氯化钾、二氧化碳和水,其化学反应方程式是:![]() ;
;
(2)根据质量守恒定律,反应后生成二氧化碳的质量为:15g+114.4g+73g-198g=4.4g,设消耗盐酸的溶质质量为y,生成氯化钾的质量为z
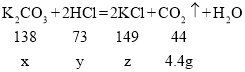
比例式为:
![]()
![]()
![]()
x=13.8g y=7.3g z=14.9g
(3)由(2)可知,白色粉末A中参加反应的物质含量为13.8g;
(4)剩余盐酸的质量为:73g×20%-7.3g=7.3g,设加入氢氧化钾的溶质质量为m,反应生成氯化钾的质量为n

![]()
![]()
m=11.2g n=14.9g
由只含有一种溶质可知,白色粉末中还含有氯化钾,氯化钾的质量为:15g-13.8g=1.2g
故C溶液中溶质成分为氯化钾和未反应的盐酸,化学式为KCl、HCl,KCl的质量为:14.9g+1.2g=16.1g,HCl的质量为:7.3g;
(5)加入氢氧化钾溶液的质量为:11.2g÷10%=112g
所得D溶液中溶质的质量分数为:
![]()

 阅读快车系列答案
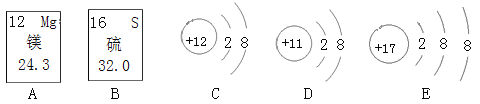
阅读快车系列答案【题目】如图A、B分别是镁元素、硫元素在元素周期表中的信息,C、D、E是三种粒子的结构示意图,表格是元素周期表的一部分。
H | He | ||||||
C | ① | ||||||
Al | ② | ③ | |||||
(1)C、D、E中与A属于同种元素的微粒是__________(填序号)。
(2)B与元素周期表中_________(填①或②或③)的化学性质相似。
(3)D微粒的符号为________。
(4)元素②的核外有________个电子层。
(5)C、E两种微粒形成的化合物的化学式是____________。
【题目】下列各图是进行氧气、二氧化碳的实验室制取和有关性质的实验装置。
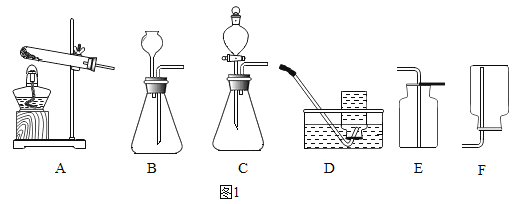
(1)图1某同学用A装置制氧气,写出该反应的化学方程式_______;若要制取一瓶二氧化碳,选用的装置为________。
(2)某化学兴趣小组的同学用图2所示的装置进行二氧化碳的性质实验(装置的气密性良好),先关闭止水夹,将足量的氢氧化钠滴入广口瓶中,充分反应后,再打开止水夹。
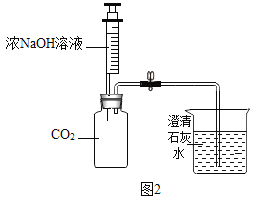
①广口瓶中观察到的现象__________。
②实验结束后,兴趣小组的同学提出新问题,广口瓶内液体的溶质可能是什么?
(猜想)
小亮:只有氢氧化钠;
小丽:氢氧化钠和氢氧化钙;
你的猜想:_______。
(探究与验证)
根据反应原理,该兴趣小组的甲、乙两位同学分别设计下列方案,对小组的猜想进行验证。实验操作、现象和结论如下表,请参与他们的探究并完成所缺内容。
实验操作 | 现象 | 结论 | |
甲 | 取少量广口瓶内液体,滴加几滴酚酞试液 | 溶液变红 | 小丽的猜想成立 |
乙 | 取少量广口瓶内液体,滴加_______(写一种盐溶液) | 产生白色沉淀 | 你的猜想成立 |
(反思与评价)
同学们认真研究实验流程,讨论后一致认为乙同学的方案合理。你认为甲同学设计的方案不合理的理由是
_________。