题目内容
【题目】合成氨是人类科学技术上的一项重大突破,也是化学对社会发展与进步做出的巨大贡献。合成氨的流程图为:
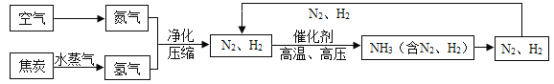
(1)制取氢气的反应为: 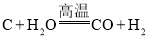 ,反应前后化合价发生变化的元素是________________(填元素符号)。
,反应前后化合价发生变化的元素是________________(填元素符号)。
(2)写出N2、H2反应生成NH3的化学方程式_______________________。
(3)流程图中将N2、H2 循环使用,目的是______________________。
(4)将沸点不同的气体分离开来,常采用液化分离法。如:控制温度在- 183°C时,可将空气中N2与O2分离。根据下表中物质的沸点判断,要将产物NH3与N2、H2分离开来,最适宜的温度应该控制在__________。
物质 | H2 | N2 | O2 | NH3 |
沸点 | -252°C | -195.8°C | -183°C | -33.35°C |
(5) 在一定条件下,A、B能发生化学反应生成C和D,其微观示意图如下
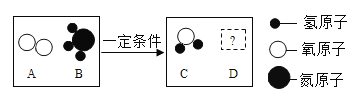
若D为空气中体积分数最大的气体,则反应中C和D的化学计量数之比为______________。
【答案】C、H ![]() 提高反应物的利用率,节约资源 -33.35°C 3:1
提高反应物的利用率,节约资源 -33.35°C 3:1
【解析】
(1)碳单质中碳元素化合价是0,一氧化碳中碳元素是+2价;水中氢元素的化合价为+1价,氢气中氢元素的化合价为0,反应前后化合价发生变化的元素是C、H。
(2)反应物是氮气、氢气生成物是氨气,用观察法配平即可,所以方程式是:![]() 。
。
(3)流程图中将N2、H2循环使用,目的是提高反应物的利用率,节约资源;
(4)根据表中物质的沸点判断,要将产物NH3与N2、H2分离开来,最适宜的温度应该控制在-33.35℃;
(5)若D为空气中体积分数最大的气体,则D为氮气,由变化的微观示意图及质量守恒定可知,反应物是氨气和氧气,生成物是氮气和水,反应的方程式是:4NH3+3O2![]() 6H2O+2N2;则反应中C和D的化学计量数之比为3:1。
6H2O+2N2;则反应中C和D的化学计量数之比为3:1。

【题目】在一个密闭容器内有四种物质,在一定条件下完全反应后,测得反应前后各物质的质量如下:
物质 | X | Y | Z | Q |
反应前质量/g | 4 | 10 | 1 | 21 |
反应后质量/g | 0 | 12 | 15 | 待测 |
已知X的相对分子质量为N,Q的相对分子质量为2N,下列推理正确的是( )
A. 反应后Q的质量为9 g
B. 反应中Y与Q发生改变的质量之比为1∶1
C. 反应后生成15 g Z
D. X与Q反应前的化学计量数之比为2∶1
【题目】现有两瓶无色溶液,可能是盐酸或者是氢氧化钠,化学实验小组同学想对这两瓶试剂进行鉴别(查阅资料,铝既可以和盐酸反应,也可以和氢氧化钠溶液反应,铝和氢氧化钠溶液反应生成偏铝酸钠( NaAlO2)和氢气)。
(1)甲组同学做了如下的实验
实验步骤 | 实验现象 | 实验结论 |
取一支试管,加入5ml无色液体,并加入紫色的石蕊试剂 | 溶液变________色 | 无色溶液是_______ |
取一支试管,加入5ml无色液体,并加入紫色的石蕊试剂 | 溶液变________色 | 无色溶液是NaOH |
(2)乙组同学用的是铝来进行的实验。取一支试管加人5毫升的无色液体,发现有气泡生成。然后同学们就说这是盐酸。此反应的化学方程式为:________________________。
(3)丙组的同学认为此方法有错,你认为乙组同学错的理由是_______________,化学方程式为______________。
(4)丁组同学在做铝与盐酸反应的实验时收集到了氢气0.2克,需要铝粉_______________克?消耗了50克的盐酸溶液,此溶液的溶质的质量分数是____________?