��Ŀ����
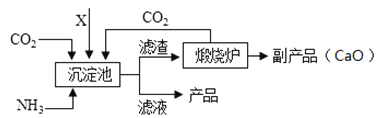
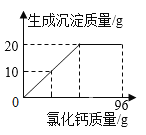
����Ŀ��ij��ѧС����ʵ�������һС����װ������������ƹ��壬��ͨ��ʵ��ͼ���ȷ����Ʒ��Na2CO3������������������������������ʵ�����������Ʒ����Ϊ18.6g����������ˮ������һ������������ϡ����ֱ���������������ϡ�������������������������ͼ���������������ȫ���ݳ�����
�Լ��㣺
��1����Ʒ��̼���Ƶ����������������ȷ��0.1%����______
��2�������ϡ���������������______
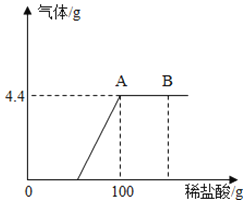
��3��B��ʱ���ձ�����Һ�е�������_____��д����ѧʽ����
���𰸡�57.0% 14.6% NaCl��HCl
��������
��1������Ʒ��̼���Ƶ�����Ϊx����̼���Ʒ�Ӧ���������ʵ�����Ϊy��
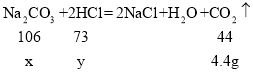
![]() ��
��
x��10.6g��y��7.3g��
������̼���Ƶ���������Ϊ��![]() ��100%��57.0%��
��100%��57.0%��
��2����Ʒ���������Ƶ�������18.6g��10.6g��8g��
�����������Ʒ�Ӧ���������ʵ�����Ϊz��
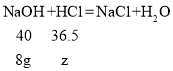
![]() ��
��
z��7.3g��
ϡ���������ʵ�������7.3g+7.3g��14.6g��
ϡ���������ʵ�����������![]() ��100%��14.6%��
��100%��14.6%��
��3����ͼ���Կ�������B��ʱ��ϡ�������������A���2����˵���������ƺ�̼���ƶ���Ӧ��ȫ���ձ�����Һ�е�����ֻʣ��NaCl��HCl��

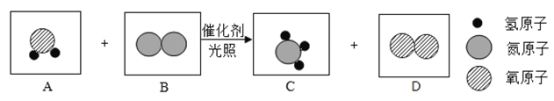
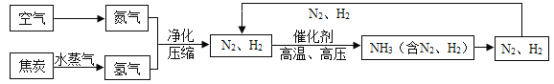
����Ŀ���ϳɰ��������ѧ�����ϵ�һ���ش�ͻ�ƣ�Ҳ�ǻ�ѧ����ᷢչ����������ľ��ס��ϳɰ�������ͼΪ:
(1)��ȡ�����ķ�ӦΪ: 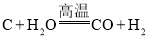 ����Ӧǰ�ϼ۷����仯��Ԫ����________________(��Ԫ�ط���)��
����Ӧǰ�ϼ۷����仯��Ԫ����________________(��Ԫ�ط���)��
(2)д��N2��H2��Ӧ����NH3�Ļ�ѧ����ʽ_______________________��
(3)����ͼ�н�N2��H2 ѭ��ʹ�ã�Ŀ����______________________��
(4)���е㲻ͬ��������뿪����������Һ�����뷨����:�����¶���- 183��Cʱ,�ɽ�������N2��O2���롣�����±������ʵķе��жϣ�Ҫ������NH3��N2��H2���뿪���������˵��¶�Ӧ�ÿ�����__________��
���� | H2 | N2 | O2 | NH3 |
�е� | -252��C | -195.8��C | -183��C | -33.35��C |
(5) ��һ�������£�A��B�ܷ�����ѧ��Ӧ����C��D,����ʾ��ͼ����
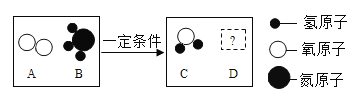
��DΪ��������������������壬��Ӧ��C��D�Ļ�ѧ������֮��Ϊ______________��