题目内容
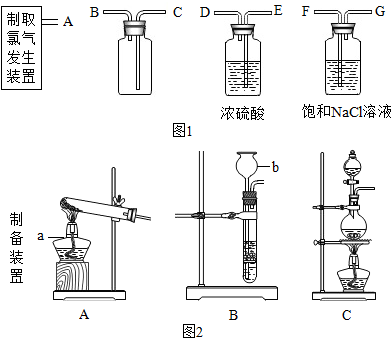 氯气(Cl2)是黄绿色有刺激性气味的气体,有毒.水溶液叫氯水.把品红试纸(染有品红的纸)伸入氯水中,品红褪色.
氯气(Cl2)是黄绿色有刺激性气味的气体,有毒.水溶液叫氯水.把品红试纸(染有品红的纸)伸入氯水中,品红褪色.【发现问题】氯水中的哪些成分能使品红褪色呢?
【查阅资料】氯气溶于水,部分与水反应,方程式为Cl2+H2O=HCl+HClO.其中,HClO的名称叫次氯酸,是一种弱酸,具有强氧化性.
【猜想】
猜想1:是氯水中的水使品红褪色的; 猜想2:是氯水中的
猜想3:是氯水中的盐酸使品红褪色的;猜想4:是氯水中的次氯酸使品红褪色的.
【实验探究】
Ⅰ.制取两瓶干燥的氯气.
实验室制取氯气的反应原理为:MnO2(固体)+4HCl(液体)
| ||
(1)X的化学式为
图中a、b仪器的名称:a
(2)连接仪器的正确顺序是(填各接口处的字母)
(3)在装置中浓硫酸的作用是
Ⅱ.
| 实验操作 | 实验现象 | 过程分析 |
| ①把品红试纸伸入水中 | 没有褪色 | 猜想1不成立 |
| ②把品红试纸伸入干燥的氯气中 | 没有褪色 | 猜想2不成立 |
| ③ | 没有褪色 | 猜想3不成立 |
综合分析:氯水中的
【反思】
(1)HClO中氯元素的化合价为
(2)氯水中加入AgNO3溶液有白色沉淀生成,化学方程式为
(3)向氯水中滴加紫色石蕊试液,观察到的现象是:先
考点:实验探究物质的性质或变化规律,常用气体的发生装置和收集装置与选取方法,气体的干燥(除水),有关元素化合价的计算,质量守恒定律及其应用,书写化学方程式、文字表达式、电离方程式
专题:科学探究
分析:本题通过实验探究分析了氯气的性质和变化规律,氯气的性质在初中教材中几乎没有介绍,只是提到了用氯气给自来水杀菌消毒.
Ⅰ.
(1)根据质量守恒定律和实验室制取氯气的反应原理,进行推测化学式;根据反应物的状态和反应条件选择装置;
(2)收集纯净、干燥的氯气,先用饱和NaCl溶液除去混在Cl2中少量的HCl气体,再用浓硫酸干燥;
(3)考虑氯气的毒性;
Ⅱ.
根据题目给出的信息和实验现象判断,能使品红褪色,具有漂白作用的是次氯酸;还要记住在化合物中正负化合价的代数和为零的原则;以及盐酸中氯离子的检验方法和与指示剂反应的颜色变化.
Ⅰ.
(1)根据质量守恒定律和实验室制取氯气的反应原理,进行推测化学式;根据反应物的状态和反应条件选择装置;
(2)收集纯净、干燥的氯气,先用饱和NaCl溶液除去混在Cl2中少量的HCl气体,再用浓硫酸干燥;
(3)考虑氯气的毒性;
Ⅱ.
根据题目给出的信息和实验现象判断,能使品红褪色,具有漂白作用的是次氯酸;还要记住在化合物中正负化合价的代数和为零的原则;以及盐酸中氯离子的检验方法和与指示剂反应的颜色变化.
解答:解:
【猜想】猜想2:氯水是指氯气溶于水,既发生一个物理变化(氯气和水),又发生一个化学变化(生产盐酸和次氯酸),因此一共有四个猜想,比较其他三个猜想,得出答案.故答案为:Cl2;
Ⅰ.制取两瓶干燥的氯气.
(1)根据质量守恒定律和实验室制取氯气的反应原理为:MnO2(固体)+4HCl(液体)
X+2H2O+Cl2↑,可知:反应前Mn原子1个、O原子2个、H原子4个、Cl原子4个,而反应后O原子2个、H原子4个、Cl原子2个,故X中Mn原子1个、Cl原子2个,故其化学式为MnCl2;
根据反应物的状态为:固体和液体,需要加热,则选择制取氯气的发生装置为C;图中a、b仪器的名称分别为酒精灯、长颈漏斗.
(2)收集纯净、干燥的氯气,先用饱和NaCl溶液除去混在Cl2中少量的HCl气体;再用浓硫酸干燥,除去水分;而氯气的密度大于空气,则长管进、短管出,故连接仪器的正确顺序是AFGEDCB;
(3)在装置中浓硫酸的作用是吸水干燥,因为氯气有毒,故该装置的缺点为从导管B处会有氯气排到空气中,污染空气.
Ⅱ.
要证明猜想3不成立,只要把品红试纸伸入到盐酸中,现象是无变化就可以了,因此能使品红变色的是次氯酸.故答案为:把品红试纸伸入到盐酸中;
【结论】因为猜想4成立,则氯水中的HClO使品红褪色,具有漂白作用.
【反思】(1)HClO中氯元素的化合价可以根据:+1+X+(-2)=0,解得X=+1.故答案为:+1;
(2)AgNO3溶液和盐酸互相交换成分生成氯化银白色沉淀和稀硝酸.故答案为:HCl+AgNO3=AgCl↓+HNO3
(3)因为氯水中有HCl和HClO,故向氯水中滴加紫色石蕊试液,观察到的现象是:先变红色后褪色.故答案为:先变红色后褪色.
故答案为:
Cl2;(1)MnCl2;C; 酒精灯; 长颈漏斗; (2)AFGEDCB; (3)吸水干燥;从导管B处会有氯气排到空气中,污染空气.③把品红试纸伸入盐酸中;HClO;+1;AgNO3+HCl=AgCl↓+AgNO3;变红,褪色
【猜想】猜想2:氯水是指氯气溶于水,既发生一个物理变化(氯气和水),又发生一个化学变化(生产盐酸和次氯酸),因此一共有四个猜想,比较其他三个猜想,得出答案.故答案为:Cl2;
Ⅰ.制取两瓶干燥的氯气.
(1)根据质量守恒定律和实验室制取氯气的反应原理为:MnO2(固体)+4HCl(液体)
| ||
根据反应物的状态为:固体和液体,需要加热,则选择制取氯气的发生装置为C;图中a、b仪器的名称分别为酒精灯、长颈漏斗.
(2)收集纯净、干燥的氯气,先用饱和NaCl溶液除去混在Cl2中少量的HCl气体;再用浓硫酸干燥,除去水分;而氯气的密度大于空气,则长管进、短管出,故连接仪器的正确顺序是AFGEDCB;
(3)在装置中浓硫酸的作用是吸水干燥,因为氯气有毒,故该装置的缺点为从导管B处会有氯气排到空气中,污染空气.
Ⅱ.
要证明猜想3不成立,只要把品红试纸伸入到盐酸中,现象是无变化就可以了,因此能使品红变色的是次氯酸.故答案为:把品红试纸伸入到盐酸中;
【结论】因为猜想4成立,则氯水中的HClO使品红褪色,具有漂白作用.
【反思】(1)HClO中氯元素的化合价可以根据:+1+X+(-2)=0,解得X=+1.故答案为:+1;
(2)AgNO3溶液和盐酸互相交换成分生成氯化银白色沉淀和稀硝酸.故答案为:HCl+AgNO3=AgCl↓+HNO3
(3)因为氯水中有HCl和HClO,故向氯水中滴加紫色石蕊试液,观察到的现象是:先变红色后褪色.故答案为:先变红色后褪色.
故答案为:
Cl2;(1)MnCl2;C; 酒精灯; 长颈漏斗; (2)AFGEDCB; (3)吸水干燥;从导管B处会有氯气排到空气中,污染空气.③把品红试纸伸入盐酸中;HClO;+1;AgNO3+HCl=AgCl↓+AgNO3;变红,褪色
点评:本考点属于实验探究题,既有气体的性质又有气体与水反应后生成物的检验,还有化学方程式的书写,综合性比较强.本题根据题目提供的信息,结合实验探究的一般步骤和酸的性质等知识来解决,还要注意化学方程式的书写和配平.本考点主要出现在实验题中.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案
相关题目