题目内容
酸、碱、盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动.
(1)盐酸、硫酸等具有相似的化学性质,是因为二者的水溶液中都含有 离子.打开盛浓盐酸和浓硫酸的试剂瓶的瓶盖,立即就能把它们区分开来,这是因为 .
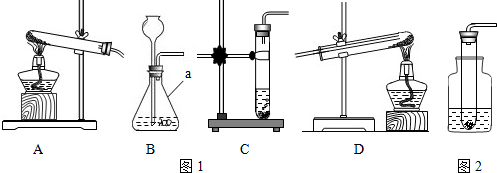
(2)如图1是甲同学设计的趣味实验装置,其气密性良好.若胶头滴管中的物质是浓NaOH溶液,锥形瓶中充满CO2,则挤压胶头滴管后能观察到什么现象? ,并写出有关反应的化学方程式 .
(3)盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末.乙同学和丙同学对这种白色粉末的成分进行了如下猜想和验证.
(Ⅰ)可能是NaOH(Ⅱ)可能是Na2CO3(Ⅲ)可能是NaOH与Na2CO3的混合物
①乙同学向所取少量粉末中滴加 溶液,观察到 的现象后,排除了(Ⅰ)的可能性.
②丙同学提议用酚酞试液来鉴定,你认为可行吗?请简要说明理由:
.
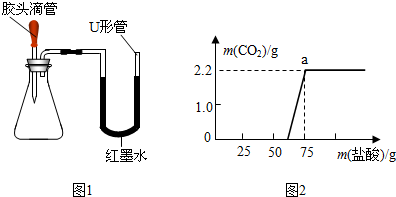
(4)某同学称取13.3g 的NaOH样品(杂质为Na2CO3),加水配成溶液100g,然后向溶液中逐滴加入稀盐酸,根据生成CO2的质量测定Na2CO3的质量.
实验测得加入稀盐酸的质量与产生CO2气体的质量关系如图2所示.
①求完全反应后生成的二氧化碳的质量是 g.
②求样品中Na2CO3的质量分数?(要求写出计算过程,结果精确到0.1%)
③假如此反应恰好完全,则所得溶液中溶质的质量分数是多少?(要求写出计算过程,结果精确到0.1%)

(1)盐酸、硫酸等具有相似的化学性质,是因为二者的水溶液中都含有
(2)如图1是甲同学设计的趣味实验装置,其气密性良好.若胶头滴管中的物质是浓NaOH溶液,锥形瓶中充满CO2,则挤压胶头滴管后能观察到什么现象?
(3)盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末.乙同学和丙同学对这种白色粉末的成分进行了如下猜想和验证.
(Ⅰ)可能是NaOH(Ⅱ)可能是Na2CO3(Ⅲ)可能是NaOH与Na2CO3的混合物
①乙同学向所取少量粉末中滴加
②丙同学提议用酚酞试液来鉴定,你认为可行吗?请简要说明理由:
(4)某同学称取13.3g 的NaOH样品(杂质为Na2CO3),加水配成溶液100g,然后向溶液中逐滴加入稀盐酸,根据生成CO2的质量测定Na2CO3的质量.
实验测得加入稀盐酸的质量与产生CO2气体的质量关系如图2所示.
①求完全反应后生成的二氧化碳的质量是
②求样品中Na2CO3的质量分数?(要求写出计算过程,结果精确到0.1%)
③假如此反应恰好完全,则所得溶液中溶质的质量分数是多少?(要求写出计算过程,结果精确到0.1%)
考点:酸的化学性质,实验探究物质的组成成分以及含量,有关溶质质量分数的简单计算,酸的物理性质及用途,碱的化学性质,盐的化学性质,根据化学反应方程式的计算
专题:科学探究,综合计算(图像型、表格型、情景型计算题)
分析:(1)根据酸的定义进行分析,
根据浓盐酸和浓硫酸的溶质进行分析,
(2)根据锥形瓶中的气压进行分析,
根据反应物、生成物书写方程式.
(3)①根据碳酸盐与酸反应会生成二氧化碳气体进行分析,
②根据酸碱指示剂的变色进行分析.
(4)根据题中的反应原理书写方程式,然后根据比例关系进行解答.
根据浓盐酸和浓硫酸的溶质进行分析,
(2)根据锥形瓶中的气压进行分析,
根据反应物、生成物书写方程式.
(3)①根据碳酸盐与酸反应会生成二氧化碳气体进行分析,
②根据酸碱指示剂的变色进行分析.
(4)根据题中的反应原理书写方程式,然后根据比例关系进行解答.
解答:解:(1)在溶液中电离出的阳离子全部是氢离子的化合物就是酸,所以酸中都有相同的离子氢离子;盐酸的溶质是氯化氢具有挥发性,氯化氢会与水蒸气生成盐酸小液滴,而硫酸的溶质是硫酸,不具有挥发性;
(2)二氧化碳与氢氧化钠反应,是锥形瓶中的气压减小,外界大气压会使U性管中的页面产生高度差,二氧化碳和氢氧化钠反应生成碳酸钠和水,故答案为:CO2+2NaOH=Na2CO3+H2O;
(3)①第一种猜想中没有碳酸钠,而后面的两种猜想中都有碳酸钠,根据碳酸钠的性质,可知滴入了盐酸;
②酚酞遇到碱性溶液都会变色,而碳酸钠和氢氧化钠都显碱性.
(4)①由图2可知生成的二氧化碳的质量为2.2g;
②设生成2.2g CO2需要Na2CO3的质量为x,同时生成NaCl的质量为y
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117 44
x y 2.2g
=
,
=
则x=5.3g y=5.85g
样品中Na2CO3的质量分数=
×100%=39.8%
③设NaOH 与HCl反应生成NaCl的质量为z,NaOH的质量是:13.3g-5.3g=8g
HCl+NaOH=NaCl+H2O
40 58.5
8g z
=
则z=11.7g
则:所得溶液中溶质的质量分数
=×100%=10.2%
答案:(1)H+; 浓盐酸具有挥发性;
(2)U形管左端液面上升; 2NaOH+CO2═Na2CO3+H2O;
(3)①稀盐酸; 有气泡冒出;②不可行 Na2CO3溶液呈碱性,无色酚酞遇Na2CO3溶液也变红;
(4)①2.2;
②样品中Na2CO3的质量分数为39.8%;
③所得溶液中溶质的质量分数为10.2%.
(2)二氧化碳与氢氧化钠反应,是锥形瓶中的气压减小,外界大气压会使U性管中的页面产生高度差,二氧化碳和氢氧化钠反应生成碳酸钠和水,故答案为:CO2+2NaOH=Na2CO3+H2O;
(3)①第一种猜想中没有碳酸钠,而后面的两种猜想中都有碳酸钠,根据碳酸钠的性质,可知滴入了盐酸;
②酚酞遇到碱性溶液都会变色,而碳酸钠和氢氧化钠都显碱性.
(4)①由图2可知生成的二氧化碳的质量为2.2g;
②设生成2.2g CO2需要Na2CO3的质量为x,同时生成NaCl的质量为y
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117 44
x y 2.2g
| 106 |
| x |
| 44 |
| 2.2 |
| 117 |
| y |
| 44 |
| 2.2g |
则x=5.3g y=5.85g
样品中Na2CO3的质量分数=
| 5.3g |
| 13.3g |
③设NaOH 与HCl反应生成NaCl的质量为z,NaOH的质量是:13.3g-5.3g=8g
HCl+NaOH=NaCl+H2O
40 58.5
8g z
| 40 |
| 8g |
| 58.5 |
| z |
则z=11.7g
则:所得溶液中溶质的质量分数
| 5.85g+11.7g |
| 100g+75g-2.2g |
答案:(1)H+; 浓盐酸具有挥发性;
(2)U形管左端液面上升; 2NaOH+CO2═Na2CO3+H2O;
(3)①稀盐酸; 有气泡冒出;②不可行 Na2CO3溶液呈碱性,无色酚酞遇Na2CO3溶液也变红;
(4)①2.2;
②样品中Na2CO3的质量分数为39.8%;
③所得溶液中溶质的质量分数为10.2%.
点评:在解此类题时,首先分析题目考查的意图,然后找出问题与书本知识的切入点,然后再根据学过的知识进行解答.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
用下列几组物质对Ag、Fe、Cu三种金属活动性顺序的探究,不可行的是( )
| A、Fe、Ag、CuSO4溶液 |
| B、Cu、Ag、FeSO4溶液 |
| C、Fe、Cu、AgNO3溶液、稀盐酸 |
| D、Cu、FeSO4溶液、AgNO3溶液 |
 氯气(Cl2)是黄绿色有刺激性气味的气体,有毒.水溶液叫氯水.把品红试纸(染有品红的纸)伸入氯水中,品红褪色.
氯气(Cl2)是黄绿色有刺激性气味的气体,有毒.水溶液叫氯水.把品红试纸(染有品红的纸)伸入氯水中,品红褪色. 人类社会的生存与发展离不开水,淡水资源和环境问题是困扰人类可持续发展的一个重要因素.当今世界上有80多个国家、约20多亿人口面临淡水危机,其中26个国家的3亿多人口生活在缺水状态中.请回答下列问题:
人类社会的生存与发展离不开水,淡水资源和环境问题是困扰人类可持续发展的一个重要因素.当今世界上有80多个国家、约20多亿人口面临淡水危机,其中26个国家的3亿多人口生活在缺水状态中.请回答下列问题: