题目内容
【题目】我国海水晒盐的历史悠久。学习小组对粗盐进行提纯,并利用氯化钠进行实验探究。
Ⅰ.粗盐的提纯
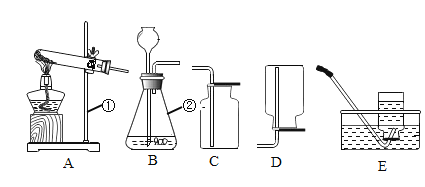
粗盐中含有不溶性泥沙、可溶性CaCl2,MgCl2等杂质。学习小组设计了如下方案提纯粗盐:

(1)用化学方程式表示Na2CO3溶液的作用:_______。
(2)“过滤”中玻璃棒的作用为_____;“操作X”的名称为______。
Ⅱ.探究氨盐水与二氧化碳的反应
步骤1 取50mL.浓氨水于锥形瓶中,加入NaCl晶体至不再溶解,制得氨盐水。
步骤2 向烧瓶中加入20mL氨盐水和约16g干冰,塞紧瓶塞,振荡、静置。一段时间后溶液中析出细小晶体,过滤、用冷水洗涤晶体并低温干燥。
(提出问题)晶体的成分是什么?
(实验探究1)①经甲同学检验,晶体中不含铵盐。甲同学的实验操作及现象是_______。
②乙同学取晶体少许,加入稀硝酸,晶体溶解并产生无色气体,再滴加几滴AgNO3溶液,未见明显现象,说明晶体中不含有______离子。
(提出猜想)晶体的成分为Na2CO3或NaHCO3或两者的混合物。
(查阅资料)Na2CO3受热不分解;
NaHCO3受热易分解:2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
(实验探究2)称取m1g晶体,利用下图装置(夹持仪器略)探究晶体的成分。
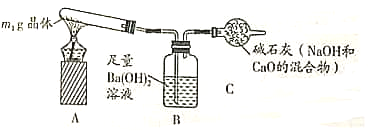
(实验现象)反应一段时间后,试管口凝结了少量小液滴,Ba(OH)2溶液变浑浊。
(实验分析)①晶体中一定含有______(填化学式)。
②将晶体加热至残留固体的质量不断改变,测得残留固体的质量为m2g。
若m1g:m2g![]() _____,说明晶体为NaHCO3。
_____,说明晶体为NaHCO3。
(拓展延伸)①氨盐水与二氧化碳反应所得铵盐的用途为_______。
②丙同学认为通过测定装置B中沉淀的质量,经计算分析也可确定晶体的组成。请对两同学的观点进行评价:________。
【答案】Na2CO3+CaCl2=CaCO3↓+2NaCl 引流 蒸发结晶 取少量晶体置于研钵中,再加入少量的熟石灰研磨,没有刺激性气味产生 氯 NaHCO3 84:53 化肥 丙同学的操作较繁琐
【解析】
I、(1)碳酸钠与氯化钙反应生成氯化钠和碳酸钙沉淀,从而出去杂质氯化钙,故反应的化学方程式写为:Na2CO3+CaCl2=CaCO3↓+2NaCl。
(2)过滤时玻璃棒的作用是引流,故填引流;
由于氯化钠的溶解度受温度影响较小,使氯化钠从溶液中结晶时常选择蒸发结晶的方法,故填蒸发结晶。
II、{实验探究1}①取少量晶体置于研钵中,再加入少量的熟石灰研磨,没有刺激性气味产生,故填取少量晶体置于研钵中,再加入少量的熟石灰研磨,没有刺激性气味产生。
②银离子与氯离子在水溶液中反应生成既不溶于水也不溶于稀硝酸的氯化银沉淀,溶液中加入硝酸银溶液,没有产生明显变化,表明溶液中不含氯离子,故填氯。
{实验分析}①将晶体在试管中加入,发现试管口凝结了少量小液滴,Ba(OH)2溶液变浑浊,说明晶体在加热条件下反应能生成二氧化碳和水,则晶体中一定含有碳酸氢钠,其化学式为NaHCO3,故填NaHCO3。
②由上述化学方程式可知,碳酸氢钠与其受热分解生成的碳酸钠的质量比为84:53,如果晶体为NaHCO3,则m1g:m2g![]() 84:53,故填84:53。
84:53,故填84:53。
{拓展延伸}①氨盐水与二氧化碳反应生成碳酸氢钠和氯化铵,氯化铵可用作化肥,故填化肥。
②两同学的分析均正确,但丙同学尚需将沉淀从溶液中过滤出来,然后洗涤、干燥、称量,步骤比较繁琐,故填丙同学的操作较繁琐。

 阅读快车系列答案
阅读快车系列答案【题目】某兴趣小组同学对实验室制取氧气的催化剂进行如下探究:
(提出问题)二氧化锰常作为氯酸钾分解制取氧气的催化剂,其他氧化物是否也能催化氯酸钾分解呢?
(查阅资料)研究表明,许多金属氧化物对氯酸钾的分解(分解时放出热量)有催化作用。分别用下列金属氧化物作催化剂,氯酸钾开始发生分解反应和反应剧烈时的温度如表所示:
氧化铁 | 氧化铝 | 氧化铜 | 氧化镁 | |
开始反应(℃) | 420 | 515 | 305 | 490 |
剧烈反应(℃) | 490 | 540 | 350 | 545 |
(1)实验室用氯酸钾制取氧气,如果不用二氧化锰作催化剂,最好选用的金属氧化物是_____。
(设计并完成实验)Ⅰ.将3.0g氯酸钾放在试管中加热
Ⅱ.将3.0g氯酸钾与1.0g二氧化锰混合均匀加热
Ⅲ.将Xg氯酸钾与1.0g氧化铜混合均匀加热
(2)实验Ⅲ中X的值应为_____,实验_____和Ⅲ比较可证明氧化铜能加快氯酸钾的分解速率。
(实验现象分析)将实验Ⅲ反应后的固体加水溶液、过滤、洗涤、干燥,若称量得到1.0g黑色粉末,再将黑色粉末和Xg氯酸钾混合加热,现象与实验Ⅲ相同。
(3)在相同温度下比较两组实验产生氧气的快慢,通常可采用的方法有_____。
(结论)氧化铜也能做氯酸钾分解的催化剂。
(4)实验Ⅲ反应的文字表达式为_____。
注意:若答对第(5)小题奖励4分,化学试卷总分不超过60分。
(5)氯酸钾分解制取氧气的快慢还与哪些因素有关?请你提出新的合理的假设和实验方案。
(假设)_____。
(实验方案)_____。
(结论)_____。