题目内容
【题目】![]() 、
、![]() 、
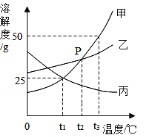
、![]() 三种物质的溶解曲线如下图所示,下列说法正确的是( )
三种物质的溶解曲线如下图所示,下列说法正确的是( )
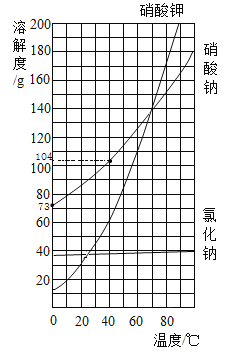
A. ![]() 的溶解度比
的溶解度比![]() 大
大
B. 将![]() 饱和溶液降温,溶液中
饱和溶液降温,溶液中![]() 的质量分数不变
的质量分数不变
C. ![]() 饱和溶液中含少量
饱和溶液中含少量![]() ,可通过降温结晶的方法提纯
,可通过降温结晶的方法提纯
D. 将100g 40℃的![]() 饱和溶液降温至0℃,析出31g晶体
饱和溶液降温至0℃,析出31g晶体
【答案】C
【解析】
A、由图可知,当温度低于20℃时,硝酸钾的溶解度比氯化钠的溶解度小,当温度高于20℃时,硝酸钾的溶解度比氯化钠的溶解度大,题目中未指明温度,所以无法比较硝酸钾与氯化钠的溶解度大小,选项错误;
B、硝酸钾的溶解度随温度升高而增大,给硝酸钾的饱和溶液降低温度,硝酸钾的溶解度变小,溶液中会有晶体析出,则溶液中硝酸钾的质量分数会变小,选项错误;
C、硝酸钾与氯化钠的溶解度均随温度升高而增大,但硝酸钾的溶解度受温度影响较大,所以硝酸钾的饱和溶液中有少量的氯化钠,可以采用降温结晶的方法来提纯硝酸钾,选项正确;
D、由图可知,40℃时硝酸钠的溶解度为104g,0℃时硝酸钠的溶解度为73g,则将204g40℃的硝酸钠饱和溶液降温至0℃才能析出31g晶体,选项错误,故选C。

练习册系列答案
相关题目