题目内容
【题目】钙被称为人体中的“钢筋混凝土”。
(人体中的钙)
(1)人体缺钙不会导致_____(填字母,下同)。
A.佝偻病 B.侏儒症 C.骨质疏松
(2)人体中钙元素主要存在于骨骼和牙齿中,以羟基磷酸钙[Ca10(PO4)6(OH)2]形式存在,其中磷元素化合价为_____。
(单质钙)
提出问题:钙的化合物很多,为什么我们很少提起单质钙呢?
思考猜想:钙的化学性质活泼。
实验验证一:如图1所示
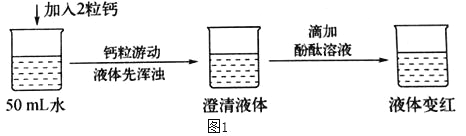
查阅资料:在一个化学反应中,有元素化合价升高,同时就有元素化合价降低。
(3)实验结论:①写出钙与水反应的化学方程式_____。
②该反应_____(填“吸收”或“放出”)热量。
(干燥剂中的钙)
提出问题:一包生石灰干燥剂,使用一段时间后可能有哪些固体?
猜想假设:固体中含有氧化钙、氢氧化钙、碳酸钙。
实验验证二:
(4)取固体样品加入水中,若温度明显升高,则含有_____;滴加酚酞后液体变红;继续加足量稀盐酸,如观察到_____,则固体中含有碳酸钙。
(5)小明认为无法判断是否含有氢氧化钙,理由是_____。
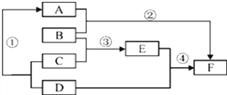
(6)为了进一步确定固体样品的成分及质量,实验小组利用如图2所示的装置(夹持仪器省略)进行实验。
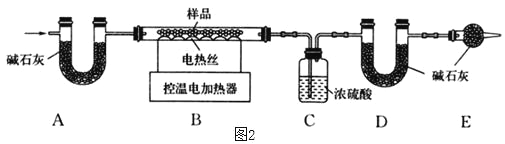
查阅资料:氢氧化钙加热至580℃、碳酸钙加热至825℃分别分解生成两种氧化物。
①实验前首先要_____,再装入药品。
②装置E的作用是_____。
③控温电加热器使装置B中反应完全,再通一段时间空气,测得反应前后装置C、D分别增重18.0g和22.0g,将装置B中反应后剩余的固体氧化物加入足量水中溶解,蒸发所得固体(不含水)增重36.0g,求原固体样品中各成分的质量__________。(请写出计算过程)
【答案】B+5 。Ca+2H2O=Ca(OH)2+H2↑ 。放出氧化钙 ;有气泡产生氧化钙与水反应生成的氢氧化钙溶液也呈碱性 。检查装置的气密性 ,防止空气中的CO2和H2O进入D 。氢氧化钙的质量为74g,含碳酸钙的质量为50g,含氧化钙的质量为28g。
【解析】
根据生石灰的性质,碱、盐的化学性质,化合物中元素化合价的代数和为零进行分析。根据实验得到的数据结合物质的性质进行计算。
(1)人体缺钙会导致佝偻病和骨质疏松,不会导致侏儒症,故选B;
(2)钙元素显+2价,氧元素显﹣2价,氢氧根显﹣1价,设:磷元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+2)×10+6x+(﹣2)×4×6+(﹣1)×2=0,则x=+5;
(3)①钙粒加入水中,钙粒的游动说明有气体生成,反应后的溶液能使酚酞变红说明的碱性物质生成,根据质量守恒定律可知该碱性物质是氢氧化钙,该反应中钙元素的化合价由0价变成了+2价,化合价升高,在一个化学反应中,有元素化合价升高,同时就有元素化合价降低。水中的氧元素化合价为-2价,氧元素的化合价已是最低不可能再降低,化合价降低的只可能是氢元素,氢元素在水中的化合价是+1价,可降低为0价,氢气的化合价为0价,所以钙与水反应生成氢气和氢氧化钙,化学方程式是Ca+2H2O=Ca(OH)2+H2↑;
②钙粒加入水中,开始时溶液变浑浊,降温后变成澄清溶液,氢氧化钙溶解度随着温度升高而减小,因此该反应属于放热反应;
(4)氧化钙与水反应生成氢氧化钙,该反应是放热反应。取固体样品加入水中,若温度明显升高,则含有氧化钙;由于生成的氢氧化钙溶液显碱性,滴加酚酞后液体变红;碳酸钙与盐酸反应生成氯化钙、水和二氧化碳。继续加足量稀盐酸,如观察到有气泡产生,则固体含有碳酸钙;
(5)氧化钙与水反应生成的氢氧化钙溶液也呈碱性,因此无法判断是否有氢氧化钙;
(6)①由于该实验需测定生成的气体质量,所以实验前首先要检查装置的气密性,再装入样品;
②碱石灰能吸收二氧化碳和水。装置D中的作用是吸收二氧化碳,空气中二氧化碳和水蒸气进入装置D会影响实验结果。装置E是为了防止空气中的二氧化碳和水蒸气进入装置D,影响实验结果;
③根据“查阅资料:氢氧化钙加热至580℃、碳酸钙加热至825℃分别分解生成两种氧化物”可知氢氧化钙分解生成氧化钙和水,碳酸钙分解生成氧化钙和二氧化碳。浓硫酸具有吸水性,碱石灰能吸收二氧化碳。控温加热使装置B中反应完全,再通一段时间空气,测得反应前后装置C、D分别增重18.0g和22.0g,则氢氧化钙分解生成水的质量为18.0g,碳酸钙分解生成二氧化碳的质量为22.0g,设:氢氧化钙的质量为x,分解生成的氧化钙的质量为y,碳酸钙的质量为z,分解生成的氧化钙的质量为m,则
Ca(OH)2![]() CaO+H2O
CaO+H2O
74 56 18
x y 18.0g
![]() x=74g
x=74g
![]() y=56g
y=56g
CaCO3 ![]() CaO+CO2↑
CaO+CO2↑
100 56 44
z m 22.0g
![]() z=50g
z=50g
![]() m=28g
m=28g
将装置B中反应后剩余的固体氧化物加入足量水中溶解,蒸发所得固体(不含水)增重36.0g,设:参加反应的氧化钙的质量为n,则
CaO+H2O= Ca(OH)2 固体增加质量
56 74 74﹣56=18
n 36.0g
![]() n=112g
n=112g
则原固体样品中CaO的质量为112g﹣56g﹣28g=28g。由以上分析可知,原固体样品中含氢氧化钙的质量为74g,含碳酸钙的质量为50g,含氧化钙的质量为28g。
答:原固体样品中含氢氧化钙的质量为74g,含碳酸钙的质量为50g,含氧化钙的质量为28g。