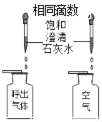
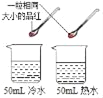
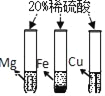
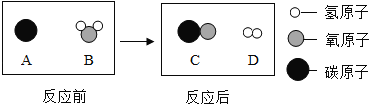
题目内容
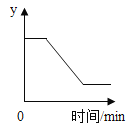
【题目】如图是不含结晶水的a、b、c 三种物质的溶解度曲线,下列说法正确的是( )
A. t2℃时,向100g物质b的饱和溶液中加入80g物质a,充分搅拌后,最终得到180g溶液
B. 将t2℃时a、b两种物质的饱和溶液降温到t1℃时,析出晶体的质量:a>b
C. 用等质量的a、b、c三种固体配制成t2℃时的饱和溶液,所得溶液质量的大小关系是:c溶液>b溶液>a溶液
D. 将t1℃时三种物质的饱和溶液升温到t2℃时,所得溶液中溶质的质量分数的大小关系是:b>a=c
【答案】C
【解析】
根据溶解度的涵义,溶解度曲线的应用,饱和溶液的溶质质量分数与溶解度的关系进行分析。
A、t2℃时,a的溶解度为80g,即t2℃时,100g水中最多溶解80g的a,t2℃时,100g物质b的饱和溶液中水的质量小于100g,加入80g物质a,a不能全部溶解,充分搅拌后,最终得不到180g溶液,错误;B、没有确定溶液的质量,无法比较析出晶体质量的大小,错误; C、t2℃时,a、b、c三种固体溶解度大小关系是a>b>c,用等质量的a、b、c三种固体配制成t2℃时的饱和溶液,所需要水的质量大小关系为c>b>a,故所得溶液质量的大小关系是:c溶液>b溶液>a溶液,正确;D、将t1℃时a、b、c三种物质饱和溶液的温度升高到t2℃时,a、b的溶解度变大,不考虑水分蒸发,溶液中溶质、溶剂的质量不变,溶质的质量分数不变,c的溶解度减小,析出晶体,溶质的质量分数减小;饱和溶液中溶质的质量分数=![]() ×100%,即溶解度大则溶质的质量分数大,t1℃时b的溶解度大于t1℃时a的溶解度大于t2℃时c的溶解度所以三种溶液的溶质质量分数由大到小的关系是b>a>c,不是b>a=c,错误。故选C。
×100%,即溶解度大则溶质的质量分数大,t1℃时b的溶解度大于t1℃时a的溶解度大于t2℃时c的溶解度所以三种溶液的溶质质量分数由大到小的关系是b>a>c,不是b>a=c,错误。故选C。

【题目】石灰石是生产玻璃、氯化钙等多种化工产品的原料。某研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来了矿石样品,并取稀盐酸200g,平均分成4份,进行实验,结果如下:
实 验 | 1 | 2 | 3 | 4 |
加入样品质量/g | 5 | 10 | 15 | 20 |
生成CO2的质量/g | 1.76 | 3.52 | 4.4 | m |
(1)第几次反应中矿石有剩余?_________;
(2)表中m值是________;
(3)试计算这种石灰石中碳酸钙的质量分数为_________。
【题目】某校研究性学习小组的同学设计了一个对比实验,探究物质溶于水时是放出热量还是吸收热量。向下图A、B、C三个实验装置中盛有一定量水的小试管里依次加入固体NaCl、NH4NO3、NaOH(加入固体物质之前,三个实验装置中U形管两端的液面持平)。
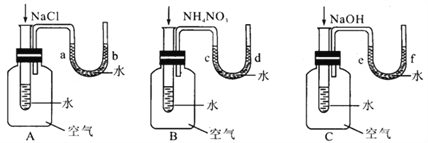
(1)请你帮他们填写下表。
A | B | C | |
现象 | ___________ | ____________ | ___________ |
原因 | __________ | ____________ | ____________ |
(2)从上述物质溶解于水的对比实验中你得出的初步结论是______________。