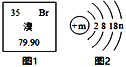
题目内容
【题目】等质量的M、N两种金属,分别与相同质量分数的足量稀盐酸反应(已知M、N在生成物中均为+2价),生成氢气质量和反应时间的关系如右图所示,下列叙述正确的是
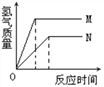
A. M、N两种金属中较活泼的是N
B. 生成H2的质量M<N
C. 相对原子质量较大的是N
D. 产生H2的速率N>M
【答案】C
【解析】A、根据图表中M反应时间短,可知M的活动性比N强.故产生H2的速率M>N,故A不正确;B、根据图表中纵坐标可知生成H2的质量M>N,故B不正确;C、根据金属与酸反应产生氢气的质量公式:氢气的质量=![]() ×金属质量,因为金属是等质量的,化合价又相等,所以氢气的质量越多,该金属的相等原子质量越小,故相对原子质量较大的是N,故C是正确的;D、根据反应时间,可知产生氢气的速度M>N,故D不正确。故选:C。
×金属质量,因为金属是等质量的,化合价又相等,所以氢气的质量越多,该金属的相等原子质量越小,故相对原子质量较大的是N,故C是正确的;D、根据反应时间,可知产生氢气的速度M>N,故D不正确。故选:C。

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目