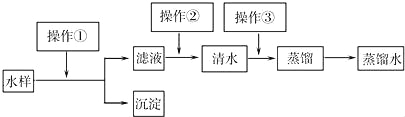
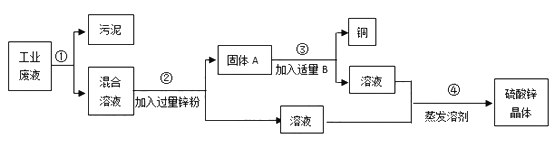
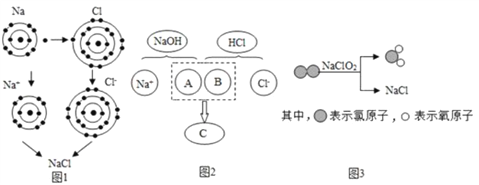
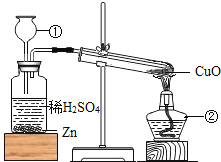
题目内容
【题目】向一定质量的硫酸铜溶液中加入不同质量的铁粉所呈现的信息如下表:
Fe质量/g | 5.6 | 11.2 | 16.8 | 22.4[ | 28 |
Cu质量/g | 6.4 | 12.8 | 19.2 | 22.4 | 22.4 |
根据信息,下图所示关系正确的是
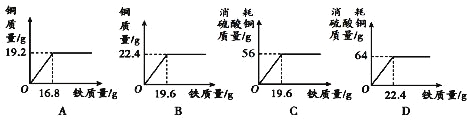
【答案】BC
【解析】
试题分析:由图表数据可知前三次每增加5.6g铁则铜的质量增加6.4g,而第四次则铜的质量没有增加6.4g,所以铁能置换出铜的最大值为22.4g,也就是溶液中铜元素的质量是22.4g.
设生成22.4g铜时需要铁的质量是x,消耗硫酸铜的质量是y
CuSO4+Fe=FeSO4+Cu
160 56 64
y x 22.4g
56/64=y/22.4g x=19.6g
160/64=y/22.4g y=56g
分析选项中的图象数据可知BC所示的质量关系正确;故选BC

 一线名师权威作业本系列答案
一线名师权威作业本系列答案【题目】一氧化碳还原氧化铁
【查阅资料】
1. 氢氧化钙溶液能吸收二氧化碳;
2. 一氧化碳还原氧化铁是逐步失去氧元素的过程。
铁及铁的氧化物 | Fe | FeO | Fe2O3 | Fe3O4 |
颜色 | 黑色 | 黑色 | 红棕色 | 黑色 |
能否被磁铁吸引 | 能 | 不能 | 不能 | 能 |
【实验探究】兴趣小组设计了如图实验装置进行实验。
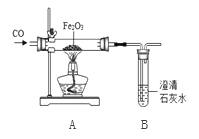
将24.0g氧化铁粉末放入玻璃管中,反应一段时间后,得到黑色固体粉末,并能全被磁铁吸引。兴趣小组猜想黑色粉末可能是(1)铁粉;(2)四氧化三铁;(3)你的猜想是________。
反应前后称量相关装置和物质的总质量,其数据如下表:
反应前 | 反应一段时间后 | |
Ⅰ 组 | 玻璃管和红色粉末的总质量为44.0 g | 玻璃管和固体物质的总质量为43.2g |
Ⅱ 组 | 试管和所盛溶液的总质量为30.0 g | 洗气瓶和瓶中物质 的总质量为32.1g |
【交流讨论】
(1)在装置A中先通CO气体的作用是__________。
(2)应该选择________组的实验数据计算来确定黑色粉末的成分,不选择另一组的理由是______。
最终计算结果表明:黑色粉末是__________,请写出该变化的化学方程式_______________。