题目内容
同学们从山上采集到一种石灰石,他们取80克该样品进行煅烧实验(所含杂质在煅烧过程中不发生变化),测得反应后固体的质量为58克.请回答下列问题:
(1)当石灰石完全反应后,生成CO2的质量为______g.
(2)求该石灰石中CaCO3的质量分数,写出计算过程.CaCO3
CaO+CO2↑
(1)当石灰石完全反应后,生成CO2的质量为______g.
(2)求该石灰石中CaCO3的质量分数,写出计算过程.CaCO3
| ||
(1)根据质量守恒定律可以知道,反应前后减少的质量为生成的二氧化碳的质量,即为:80g-58g=22g;
(2)设石灰石中碳酸钙的质量为x
CaCO3
CaO+CO2↑
100 44
x 22
=
解得:x=50g;
该石灰石中CaCO3的质量分数为:
×100%=62.5%
答:该石灰石中CaCO3的质量分数为62.5%.
(2)设石灰石中碳酸钙的质量为x
CaCO3
| ||
100 44
x 22
| 100 |
| x |
| 44 |
| 22g |
解得:x=50g;
该石灰石中CaCO3的质量分数为:
| 50g |
| 80g |
答:该石灰石中CaCO3的质量分数为62.5%.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
同学们从山上采集到一种石灰石,他们取80 g该样品进行煅烧实验(所含杂质在煅烧过程中不发生变化),测得反应后固体的质量(m)与反应时间(t)的关系如表:
请回答下列问题:
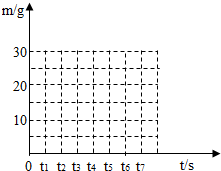
(1)当石灰石完全反应后,生成CO2的质量为 g.
(2)求该石灰石中CaCO3的质量分数,写出计算过程.
(3)请在如图所示的坐标图中,画出煅烧时生成气体的质量(m)随时间(t)变化的曲线.
| 反应时间t∕s | t0 | t1 | t2 | t3 | t4 | t5 | t6 |
| 反应后固体的质量m∕g | 80 | 75 | 70 | 66 | 62 | 58 | 58 |

(1)当石灰石完全反应后,生成CO2的质量为
(2)求该石灰石中CaCO3的质量分数,写出计算过程.
(3)请在如图所示的坐标图中,画出煅烧时生成气体的质量(m)随时间(t)变化的曲线.
同学们从山上采集到一种石灰石,他们取80克该样品进行煅烧实验(所含杂质在煅烧过程中不发生变化),测得反应后固体的质量(m)与反应时间(t)的关系如下表:
请回答下列问题:
(1)当石灰石完全反应后,生成CO2的质量为 g.
(2)求该石灰石中CaCO3的质量分数,写出计算过程.
| 反应时间t∕s | t0 | t1 | t2 | t3 | t4 | t5 | t6 |
| 反应后固体的质量m∕g | 80 | 75 | 70 | 66 | 62 | 58 | 58 |
(1)当石灰石完全反应后,生成CO2的质量为
(2)求该石灰石中CaCO3的质量分数,写出计算过程.
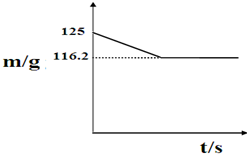 兴趣小组的同学们从山上采集到一种石灰石(主要成分为碳酸钙),他们将25克该样品放入盛有100g稀盐酸的烧杯中,恰好完全反应(杂质不与稀盐酸反应,也不溶于水),测得反应后烧杯中剩余物质的质量(m)与反应时间(t)的关系如图:
兴趣小组的同学们从山上采集到一种石灰石(主要成分为碳酸钙),他们将25克该样品放入盛有100g稀盐酸的烧杯中,恰好完全反应(杂质不与稀盐酸反应,也不溶于水),测得反应后烧杯中剩余物质的质量(m)与反应时间(t)的关系如图: