题目内容
(2013?荔城区模拟)同学们从山上采集到一种石灰石,他们取80克该样品进行煅烧实验(所含杂质在煅烧过程中不发生变化),测得反应后固体的质量为58克.请回答下列问题:
(1)当石灰石完全反应后,生成CO2的质量为
(2)求该石灰石中CaCO3的质量分数,写出计算过程.CaCO3
CaO+CO2↑
(1)当石灰石完全反应后,生成CO2的质量为
22
22
g.(2)求该石灰石中CaCO3的质量分数,写出计算过程.CaCO3
| ||
分析:(1)根据质量守恒定律可以知道,反应前后减少的质量为生成的二氧化碳的质量,可以据此解答;
(2)根据二氧化碳的质量结合反应的化学方程式可以计算出碳酸钙的质量,然后求出其质量分数即可.
(2)根据二氧化碳的质量结合反应的化学方程式可以计算出碳酸钙的质量,然后求出其质量分数即可.
解答:解:(1)根据质量守恒定律可以知道,反应前后减少的质量为生成的二氧化碳的质量,即为:80g-58g=22g;
(2)设石灰石中碳酸钙的质量为x
CaCO3
CaO+CO2↑
100 44
x 22
=
解得:x=50g;
该石灰石中CaCO3的质量分数为:
×100%=62.5%
答:该石灰石中CaCO3的质量分数为62.5%.
(2)设石灰石中碳酸钙的质量为x
CaCO3
| ||
100 44
x 22
| 100 |
| x |
| 44 |
| 22g |
解得:x=50g;
该石灰石中CaCO3的质量分数为:
| 50g |
| 80g |
答:该石灰石中CaCO3的质量分数为62.5%.
点评:学会运用质量守恒定律这一原理来分析并解决问题,本题中结合质量守恒定律分析得到生成二氧化碳的质量,是解决问题的基础,也体现分析问题的能力.

练习册系列答案
相关题目
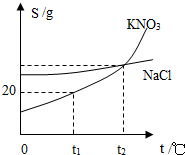 (2013?荔城区模拟)如图是KNO3 和NaCl 的溶解度曲线.下列说法中正确的是( )
(2013?荔城区模拟)如图是KNO3 和NaCl 的溶解度曲线.下列说法中正确的是( ) (2013?荔城区模拟)兔首和鼠首是圆明园遗留下来的两件文物,两件文物均为青铜器,青铜属于( )
(2013?荔城区模拟)兔首和鼠首是圆明园遗留下来的两件文物,两件文物均为青铜器,青铜属于( ) (2013?荔城区模拟)某化学活动小组以“酸碱盐的性质”为主题进行探究性学习,请你来解决下列问题:
(2013?荔城区模拟)某化学活动小组以“酸碱盐的性质”为主题进行探究性学习,请你来解决下列问题: