��Ŀ����
����Ŀ����8�֣�ij��ѧС�����̽��������������Һ�����ᷢ���кͷ�Ӧʱ��Һ�¶ȵı仯�������
ʵ����Ʒ��37%��Ũ���ᣨ�ܶ�Ϊ1��18g/mL����10%������������Һ������ˮ����Ͳ���¶ȼ�
ʵ��һ������100mL 10%�����ᣨ�ܶ�Ϊ1��05g/mL��
ʵ�鲽��
��1�����㣺��Ҫ37%��Ũ��������Ϊ mL����ȷ��0��01mL����ͬ������Ҫ����ˮ�����Ϊ mL��ˮ���ܶ�Ϊ1��0g/mL��
��2����ȡŨ���������ˮ��
��3�����������
ʵ�������һ�������10%������������Һ�еμ�10%�����ᣨ�����£�����Ӧ����Һ�¶ȵı仯���£�

��1�����С�t1��ֵΪ ��
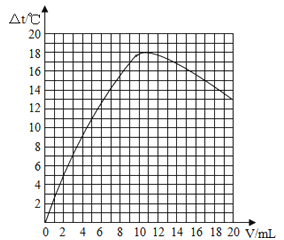
��2���Ի����Һ�¶ȱ仯������������֮��Ĺ�ϵͼ��
��3�������������߷�������������������0��10mLʱ����Һ�¶ȱ仯�����Ƽ���ԭ���� ��
��4�������������䣬������20%��������еμӣ���϶��������ߵķ�����������������ߵ��λ�ã���������Һ�ܶȺͱ����ݵı仯������ɢʧ��Ӱ�����أ���
�����꼰�������ɣ� ��
�����꼰�������ɣ� ��
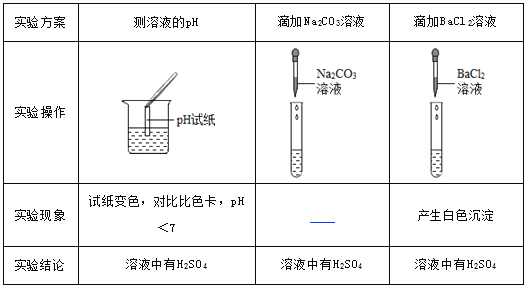
���𰸡�ʵ��һ��24��05��76��62��1��ʵ�������1��0��2��
��3�������кͷ�Ӧ�Ľ��У����ڷ�Ӧ���ȣ���Һ�¶�������4��5����ǡ����ȫ��Ӧʱ���ų����������ֵ��ԭʵ����ͬ����ʱ����20%������������ԭ���Ķ���֮һ������18��2��ֵ����ǡ����ȫ��Ӧʱ���ų����������ֵ��ԭʵ����ͬ����ʱʵ����������ԭʵ��С�����ԡ�t���ֵ����18��2��
��������
�������������Ҫ37%��Ũ��������Ϊx��37%��x��1.18g/mL=100mL��1.05g/mL��10% x=24.05mL����Ҫˮ������Ϊ��100mL��1.05g/mL��24.05mL��1.18g/mL=76.62g����76.62mL��û�м������ᣬ��Ӧû�н��У������¶Ȳ���ı䣬��˱��С�t1��ֵΪ0����������������0��10mLʱ����Һ�¶ȱ仯�����Ƽ���ԭ���������кͷ�Ӧ�Ľ��У����ڷ�Ӧ���ȣ���Һ�¶�������������20%��������еμӣ�������Ϊ5�����������ǵ�ǡ����ȫ��Ӧʱ���ų����������ֵ��ԭʵ����ͬ����ʱ����20%������������ԭ���Ķ���֮һ���������Ǵ���18.2��,���������ǵ�ǡ����ȫ��Ӧʱ���ų����������ֵ��ԭʵ����ͬ����ʱʵ����������ԭʵ��С�����ԡ�t���ֵ����18.2�档

 Сѧ��10���ӿ������100��ϵ�д�
Сѧ��10���ӿ������100��ϵ�д�����Ŀ����һС������ɫ�Ľ����Ʒ����ڿ����лᷢ�����б仯��
�ƣ�Na��![]() �Ƶ�������
�Ƶ�������![]() ����������Һ
����������Һ![]() ��ɫ����
��ɫ����
��������⡿������������������Ӧ����������Щ��
���������ϡ����Ƶ�������������ƣ�Na2O����й������ƣ�Na2O2������������������ƶ�����ˮ������Ӧ������ʽ���£�
Na2O+H2O=2NaOH��2Na2O2+2H2O=4NaOH+O2��
���������롿������������������Ӧ�IJ��
����1��Na2O��
����2��Na2O2��
����3��
��ʵ��̽��һ����
ʵ����� | ʵ������ | ʵ����� |
ȡ�����Ƶ������������������ˮ | ����1��ȷ |
������̽���������ڿ����з���һ��ʱ��õ���ɫ����ijɷ�
���������롿
����һ��Na2CO3
�������Na2CO3��NaOH
��ʵ��̽��������
ʵ����� | ʵ������ | ʵ����� |
1��ȡ������ɫ����������� | ������ɫ���� | ��ɫ����ɷ�ΪNa2CO3��NaOH |
2�����ˡ�ȡ������Һ���� |
��ʵ�鷴˼��
��1���������ͭ������ķ�Ӧ��д�������������ᷴӦ�Ļ�ѧ����ʽ ��
��2����������Ҳ�������ᷴӦ������ʽΪ��2Na2O2+4HCl=4NaCl+2H2O+X��X�Ļ�ѧʽΪ ��
��3�������ᷴӦֻ�����κ�ˮ���������Ϊ������������ж�Na2O2 �����������ǡ����ǡ�����