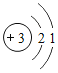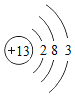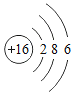题目内容
【题目】元素周期表是化学学习和研究的重要工具。下图是元素周期表的一部分,回答有关问题:
族 周期 | I A | II A | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | 3 Li 锂 6.941 | 4 Be 铍 9.012 | 5 B 硼 10.81 | 6 C 碳 12.01 | 7 N 氮 14.01 | 8 O 氧 16.00 | 9 F 氟 19.00 | 10 Ne 氖 20.18 |
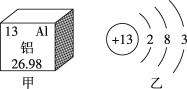
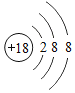
3 | 11 Na 钠 22.99 | 12 Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.06 | 17 Cl 氯 35.45 | 18 Ar 氩 39.95 |
(1)从表中查出硅(Si)元素的相对原子质量为_____。
(2)6~11号元素中,_____(填元素符号)元素的原子在化学反应中失去电子形成离子。
(3)表中不同种元素最本质的区别是_____(填字母):
A 质子数不同 B 中子数不同 C 最外层电子数不同
(4)画出第13号元素铝的原子结构示意图_____。
(5)在元素周期表中,同一周期(横行)的规律:_____。
(6)在元素周期表中,同一族(纵行)的元素具有相似的化学性质。则下列各组元素具有相似化学性质的是_____(填序号)。
a.C和Ne b.Be和Mg c.Al和Si d.F和Ar
【答案】28.09 Na A 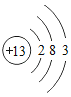 电子层数相同,最外层电子数依次增大 b
电子层数相同,最外层电子数依次增大 b
【解析】
(1)元素周期表中的一格可知:汉字下面的数字表示相对原子质量。从表中查出硅(Si)元素的相对原子质量为28.09;
(2)6~11号元素中,Na元素的原子最外层电子数为1,在化学反应中失去电子形成离子。
(3)元素是具有相同核电荷数(质子数)的同一类原子总称。表中不同种元素最本质的区别是质子数不同,故选A;
(4)第13号元素铝的原子核电荷数为13,核外电子数为13,根据核外电子排布规律,可知,第1层排2个电子,第2层排8个电子,第3层排3个电子,其结构示意图为: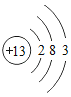 ;
;
(5)在元素周期表中,同一周期(横行)的规律是电子层数相同,最外层电子数依次增大;
(6)
a C和Ne不在同一族(纵行),化学性质不相似,不符合题意;
b Be和Mg在同一族(纵行),化学性质相似,符合题意;
c Al和Si不在同一族(纵行),化学性质不相似,不符合题意;
d F和Ar不在同一族(纵行),化学性质不相似,不符合题意。故选b。

 天天向上口算本系列答案
天天向上口算本系列答案【题目】化学实验小组设计如图装置:通过测定产生相同体积气体所用时间长短来探究影响双氧水分解速率的因素。
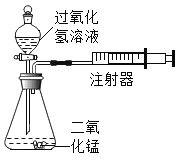
(1)实验小组有如下设计方案,完成下表。
实验编号 | 实验目的 | 温度 | 催化剂 | 浓度 | 所需时间 |
实验I | 探究________ 对H2O2分解速率的影响 | 25℃ | 二氧化锰 | 10mL2%H2O2 | 60秒 |
实验II | 25℃ | 二氧化锰 | 10mL12%H2O2 | 30秒 |
由上表数据可知:双氧水的浓度越大,其分解速率________
(2)催化剂在生产、生活和科研中的地位越来越重要。实验室用过氧化氢溶液分解制取氧气时,就常用二氧化锰作催化剂。
[提出问题]氧化铜(CuO)能否起到类似MnO2的催化剂作用呢?
[猜想假设]猜想一: CuO不是该反应的催化剂。
猜想二: CuO参与反应产生O2,反应前后质量和化学性质发生了改变。
猜想三: CuO是反应的催化剂,反应前后_______
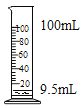
[实验探究]用天平称量0.2gCu0,取5mL5%的过氧化氢溶液于试管中,进行如下实验:

(注:氧化铜不落于水。过滤可与水分离)
[交流讨论]
(1)填写下表
步驟③现象 | 步驟⑤结果 | 结论 |
产生大量的气泡,带火星的木条发燃。 | 得到氧化铜的质量为__g | 猜想一、二不成立:猜想三成立。 |
(2)步骤④需用到的玻璃仪器有:玻璃棒、烧杯和________其中玻璃棒的作用________