题目内容
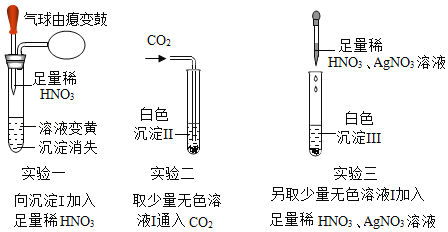
【题目】A、B、C、D、E为初中化学常见五种不同类别的物质,它们之间的关系如图所示(“一”表示相连的两种物质能发生反应,“→”表示一种物质转化成另一种物质。反应条件、部分反应物和生成物已略去)。若A、B、C均含有一种相同的金属元素,A→B是化合反应,常温下E是一种无色无味的气体,且相对分子质量最小。

请回答下列问题:
(1)请写出物质A、C的化学式:A_____,C_____。
(2)E的名称是_____,D是_______ (填酸、碱、盐).
(3)请写出A→B反应的化学方程式_____。
【答案】CaO CaCO3 氢气 酸 CaO+H2O=Ca(OH)2
【解析】
(1)A、B、C、D、E为初中化学常见五种不同类别的物质,若A、B、C均含有一种相同金属元素,A→B是化合反应,所以A是氧化钙,B是氢氧化钙,C会转化成氧化钙,所以C是碳酸钙,D会与碳酸钙、氧化钙、氢氧化钙反应,所以D是盐酸,常温下E是一种无色无味的气体,所以E是氢气,经过验证,推导正确,所以A是CaO,C是CaCO3;
(2)E的名称是氢气,D是酸;
(3)A→B的反应是氧化钙和水反应生成氢氧化钙,化学方程式为:CaO+H2O=Ca(OH)2。
故答案为:(1)CaO,CaCO3;
(2)氢气,酸;
(3)CaO+H2O=Ca(OH)2。

【题目】铜镁合金常用做飞机天线等导电材料。欲测定合金的组成(其他元素忽略不计),进行如下实验:取铜镁合金10g放入烧杯,将200g稀硫酸分4次加入烧杯中,充分反应后,测得剩余固体的质量记录如下。请计算:
次 数 | 1 | 2 | 3 | 4 |
加入稀硫酸质量/g | 50 | 50 | 50 | 50 |
剩余固体质量/g | 8.5 | 7 | 6.6 | 6.6 |
(1)铜镁合金中铜的质量分数。
(2)求所加稀硫酸中溶质的质量分数。(写出计算过程)
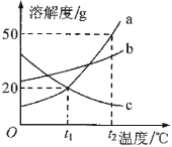
【题目】硫酸锂(Li2SO4)和硝酸钾在不同温度时的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 30 | 40 | |
溶解 度/g | Li2SO4 | 36.1 | 35.4 | 34.8 | 34.3 | 33.9 |
KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | |
请回答下列问题:

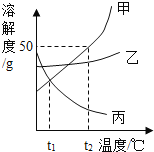
(1)依据溶解度表,绘制溶解度曲线如图所示,其中能表示Li2SO4溶解度曲线的是_______(填“甲”或“乙”)。
(2)Li2SO4和KNO3在某一温度时具有相同的溶解度x,则x的范围是_________________。
(3)40℃时,有含少量Li2SO4的KNO3饱和溶液,欲从中提纯KNO3晶体,方法是________________。
(4)将10℃时两种物质的饱和溶液分别升温至30℃,所得Li2SO4溶液中溶质的质量分数__________(填“>”、“<”或“=”)KNO3溶液中溶质的质量分数。
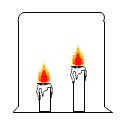
(5)如图所示,20℃时,将盛有饱和Li2SO4溶液的试管放入盛水的烧杯中,向烧杯的水中加入某物质后,试管内有晶体析出。则加入的物质可以是______(填字母序号)。
①浓硫酸 ②冰块 ③生石灰固体 ④硝酸铵固体 ⑤氢氧化钠固体
A.②④ B.①③⑤ C.③④ D.①②⑤