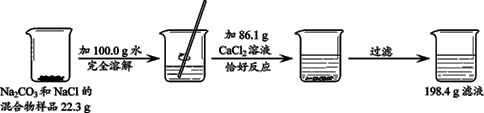题目内容
(6分)为测定某样品中锌的质量分数,取10g此样品,分五次向其中加入稀硫酸使之充分反应(假设锌的样品中杂质不与稀硫酸反应,且不溶于水),每次加入的稀硫酸质量及测定剩余固体的质量,记录数据如下表:
请认真分析表中的数据,回答下列问题:
(1)表示样品与稀硫酸恰好完全反应的是上表中第________次操作;
(2)计算样品中锌的质量分数;
(3)计算实验中所用稀硫酸的溶质质量分数。
| | 第一次 | 第二次 | 第三次 | 第四次 | 第五次 |
| 加入稀硫酸的质量/g | 10 | 10 | 10 | 10 | 10 |
| 剩余固体质量/g | 8.4 | 6.8 | 5.2 | 3.6 | 3.6 |
(1)表示样品与稀硫酸恰好完全反应的是上表中第________次操作;
(2)计算样品中锌的质量分数;
(3)计算实验中所用稀硫酸的溶质质量分数。
(1)4(2)锌的质量分数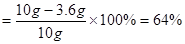
(3)设恰好完全反应时消耗硫酸的质量为x
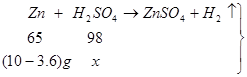
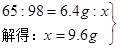

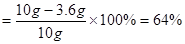
(3)设恰好完全反应时消耗硫酸的质量为x
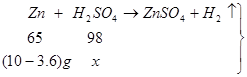
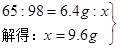

本题考查的是实验数据处理的探究和根据化学反应方程式的计算。
(1)根据金属活动性,锌在活动性顺序中处于H之前,能与稀硫酸反应,而锌的样品中杂质不与稀硫酸反应,且不溶于水。由记录数据表可知:第五次加入10g稀硫酸时,剩余固体质量不变仍为3.6g,说明混合物中的锌在第四次加酸后就已完全反应,剩余固体为不与硫酸反应的杂质。另据上表可见,前三次中每加入10g的稀硫酸,都消耗1.6g的锌,二者结合分析故知第四次恰好完全反应。
(2)则样品中锌的质量分数m=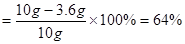
(3)设恰好完全反应时消耗硫酸的质量为x
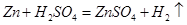
65 98
(10﹣3.6) X
65/98=(10﹣3.6)/x
X=9.6g
∴所用稀硫酸的溶质质量分数=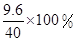 =24℅
=24℅
(1)根据金属活动性,锌在活动性顺序中处于H之前,能与稀硫酸反应,而锌的样品中杂质不与稀硫酸反应,且不溶于水。由记录数据表可知:第五次加入10g稀硫酸时,剩余固体质量不变仍为3.6g,说明混合物中的锌在第四次加酸后就已完全反应,剩余固体为不与硫酸反应的杂质。另据上表可见,前三次中每加入10g的稀硫酸,都消耗1.6g的锌,二者结合分析故知第四次恰好完全反应。
(2)则样品中锌的质量分数m=
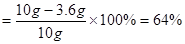
(3)设恰好完全反应时消耗硫酸的质量为x
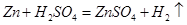
65 98
(10﹣3.6) X
65/98=(10﹣3.6)/x
X=9.6g
∴所用稀硫酸的溶质质量分数=
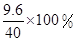 =24℅
=24℅
练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
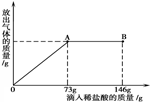
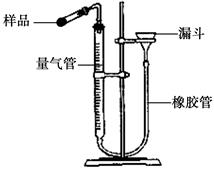
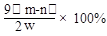 。此方案测定结果偏小的原因可能是 。
。此方案测定结果偏小的原因可能是 。