题目内容
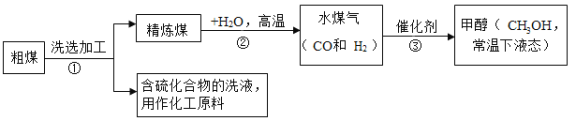
【题目】钢铁是重要的金属材料,在工农业生产和生活中应用非常广泛。
Ⅰ.铁的冶炼
工业炼铁的原理是高温下用CO作还原剂,将铁从氧化物中还原出来。请回答下列问题:
(1)写出以赤铁矿为原料,在高温下炼铁的化学方程式:___________________________;
(2)实验探究炼铁原理
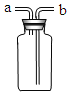
某化学兴趣小组在实验室中模拟工业炼铁的原理,并探究CO与Fe2O3反应后的产物。
通过查阅资料知道:①草酸(H2C2O4)固体与浓硫酸混合加热会产生一氧化碳,反应方程式为:H2C2O4 ![]() CO↑+ CO2↑+ H2O。
CO↑+ CO2↑+ H2O。
②NaOH溶液可以吸收二氧化碳,反应方程式为:2NaOH+CO2=Na2CO3+H2O
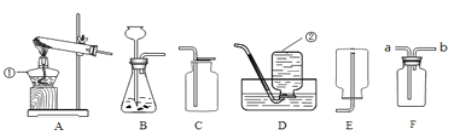
③常温下,Ca(OH)2微溶于水;于是他设计了下图的实验装置,结合装置回答下列问题:
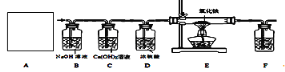
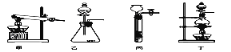
(1)图A是用固体草酸和浓硫酸制取CO的反应装置,你认为应选择下图中的_________(填装置编号);
(2)图中装置C、D的作用分别是 ____________、_______________;
(3)为了证明产物中有二氧化碳,装置F中的试剂应该是少量的_____________(填试剂名称),反应的化学方程式为 ______________________;
(4)该装置设计有一个明显缺陷,你认为是______________________________。
(5)实验时准确称取一定质量纯净的Fe2O3固体按上图进行实验,当E中固体全部变黑后,继续通入CO直到玻璃管冷却。将得到黑色的固体加入到足量的稀盐酸,发现固体全部溶解,但无气泡产生。
查阅资料:a. 铁的氧化物在足量的稀盐酸中均能全部溶解。
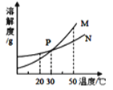
b. Fe2O3与CO反应的固体生成物可能情况如下:
![]()
根据“无气泡”猜想,黑色粉末可能是:① Fe3O4 ;②_________ ③ ____________。
(6)定量分析 用电子天平称量得部分数据如下:
玻璃管质量 | 玻璃管及其中固体的质量 | 装置F及其中物质的总质量 | |
反应前 | 28.20 g | 33.00 g | 300.0 g |
反应后 | 32.84 g | 300.4 g |
根据上述数据,纯净的Fe2O3固体质量为_____________g,请选择有效的数据,推断出反应后黑色固体的成分(写出计算过程)__________________________。
根据推断结果,写出该实验中玻璃管内发生的化学反应方程式:__________________________。
【答案】Fe2O3+3CO![]() 2Fe+3CO2丁证明CO2是否已经除尽吸收水分(或干燥CO)澄清的石灰水(或氢氧化钙溶液)CO2+Ca(OH)2═CaCO3↓+H2O;缺少尾气处理装置FeOFe3O4和FeO4.80Fe3O4CO+3Fe2O3
2Fe+3CO2丁证明CO2是否已经除尽吸收水分(或干燥CO)澄清的石灰水(或氢氧化钙溶液)CO2+Ca(OH)2═CaCO3↓+H2O;缺少尾气处理装置FeOFe3O4和FeO4.80Fe3O4CO+3Fe2O3![]() 2Fe3O4+CO2
2Fe3O4+CO2
【解析】
(1)炼铁的原理是氧化铁与一氧化碳在高温的条件下反应生成铁和二氧化碳,故化学方程式写为Fe2O3+3CO![]() 2Fe+3CO2;
2Fe+3CO2;
(2)固体草酸和浓硫酸制取CO是固液加热制取气体,发生装置选择固液加热的发生装置,故填丁;
(3)B装置用来除去二氧化碳,C装置用来检验二氧化碳是否除尽,证明CO2是否已经除尽故填;
(4)D中浓硫酸具有吸水性,可以干燥气体,故填吸收水分(或干燥CO);
(5)化学上用澄清的石灰水来检验二氧化碳,故填澄清的石灰水(或氢氧化钙溶液);
(6)石灰水中的氢氧化钙与二氧化碳反应生成碳酸钙沉淀和水,故反应的化学方程式写为Ca(OH)2+CO2═CaCO3↓+H2O;
(7)尾气中有残留的一氧化碳,直接排放会污染空气,装置中缺少尾气处理装置,故填缺少尾气处理装置;
(8)黑色的固体加入到足量的稀盐酸,发现固体全部溶解,但无气泡产生,说明没有铁生成,则黑色固体只能是Fe3O4和FeO,故②填FeO③填Fe3O4和FeO;
(9)纯净的Fe2O3固体质量为=33.00 g-28.20 g=4.80 g,故填4.80。
(10)解:纯净的Fe2O3固体中铁元素的质量=4.80g×![]() 100%=3.36 g
100%=3.36 g
氧元素的质量=4.80g-3.36g=1.44 g
反应后损失的氧元素的质量=33.00g-32.84g=0.16g
反应后黑色固体中氧元素的质量=1.44g-0.16g=1.28g
设反应后黑色固体的化学式为FexOy
铁元素质量:氧元素质量=56x:16y=3.36g:1.28g
x:y=3:4
所以剩余黑色固体的成分的化学式为Fe3O4
故填Fe3O4;
(11)综合以上可知,氧化铁和一氧化碳在加热条件下反应生成四氧化铁和二氧化碳,故化学方程式写为CO+3Fe2O3 ![]() 2Fe3O4+CO2。
2Fe3O4+CO2。

【题目】对下列实验指定容器中的水,其解释没有体现水的主要作用的是 ( )
实 验 装 置 |
硫在氧气中燃烧 |
排水法收集氧气 |
测定空气中氧气含量 |
铁丝在氧气中燃烧 |
解释 | 集气瓶中的水: 吸收放出的热量 | 集气瓶中的水: 水将集气瓶内的空气排干净,便于观察氧气何时收集满 | 量筒中的水: 通过水体积的变化得出氧气体积 | 集气瓶中的水: 冷却溅落熔化物,防止集气瓶炸裂 |
A | B | C | D |
A. A B. B C. C D. D
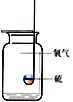
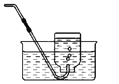
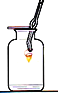
【题目】某化学兴趣小组对空气中氧气含量测定的再认识.
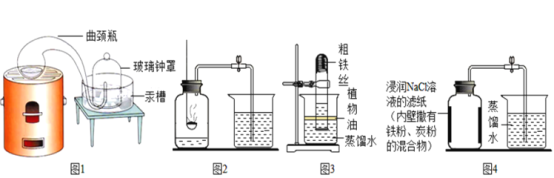
(经典赏析)教材中介绍了拉瓦锡用定量的方法研究了空气的成分(实验装置如图1)。
(1)下列有关该实验说法正确的是_______。
A.实验装置简单,加热时间短
B.汞槽中的汞可以起到液封作用
C.生成的红色粉末加热分解又能得到汞和氧气
D.能将密闭装置内空气中的氧气几乎耗尽
(2)通过该实验,拉瓦锡得出了空气是由氮气和氧气组成,氧气约占空气总体积的____。
(实验回顾)实验室常用红磷燃烧的方法测定空气中氧气的含量(装置如图2),写出红磷燃烧的文字或者符号表达式______________。兴趣小组用该方法测出的氧气含量12%,发现结果明显偏低,可能的原因是:(1)装置漏气;(2)___;(3)…
(结论与反思)多次实验证明红磷燃烧测定空气中氧气含量都明显低于21% ,通过查阅资料显示:当氧气的体积分数低于7%,红磷就要熄灭,无法将氧气耗尽,所以误差较大。
(实验探究1)已知铁生锈是与空气中的氧气和水发生化学反应的过程,生成一种暗红色的固体。小明根据铁生锈的原理,探究用铁能否准确测定空气中氧气的含量,于是进行了实验(装置如图3),通过7天测得的数据计算空气中氧气的含量为19.13%。
(交流与反思)实验结束后能观察到的现象是铁丝表面有暗红色物质生成、试管内液面_______(填“上升”“下降”或“不变”)。
与用红磷燃烧的方法相比,用铁丝生锈的方法测定空气中氧气的含量的主要优点是:___________________________。
(实验探究2)为了加快反应速率,小明通过查阅资料,利用铁粉、炭粉、氯化钠、蒸馏水等物质又进行了实验(装置如图4),8分钟后测得的数据如表:
实验前的体积 | 实验后的体积 | |
集气瓶内空气 | 烧杯内蒸馏水 | 烧杯内剩余蒸馏水 |
130mL | 90.0mL | 63.6mL |
请计算出空气中氧气含量_____________(计算结果保留一位小数)
(结论与反思)通过上述实验探究,利用铁粉比铁丝可快速地完成实验并减小实验误差,你认为可能的原因是_______(填序号);
A.相同条件下,铁粉与反应物间有更大的接触面积,能使反应更快速充分
B.两者是不同物质,铁粉的化学性质更活泼,更容易与氧气反应
实验中炭粉、氯化钠能明显加快反应速率,则它们在反应中所起的作用可能是______作用。
(拓展延伸)常温下铜能与氧气、水、二氧化碳反应而锈蚀,生成铜绿(Cu2(OH)2CO3),写出该反应的文字或符号表达式_______,但若缺少其中一种物质则铜不会锈蚀。若将图3装置中的粗铁丝换成足量的铜丝进行实验,请判断能否比较准确地测定空气中氧气的含量,并说明理由_________。