题目内容
【题目】某化学兴趣小组对空气中氧气含量测定的再认识.
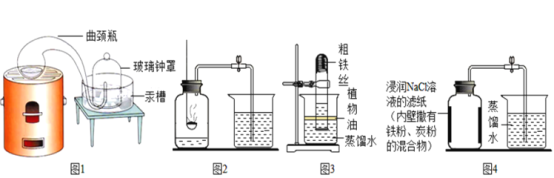
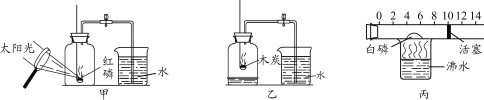
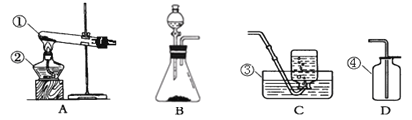
(经典赏析)教材中介绍了拉瓦锡用定量的方法研究了空气的成分(实验装置如图1)。
(1)下列有关该实验说法正确的是_______。
A.实验装置简单,加热时间短
B.汞槽中的汞可以起到液封作用
C.生成的红色粉末加热分解又能得到汞和氧气
D.能将密闭装置内空气中的氧气几乎耗尽
(2)通过该实验,拉瓦锡得出了空气是由氮气和氧气组成,氧气约占空气总体积的____。
(实验回顾)实验室常用红磷燃烧的方法测定空气中氧气的含量(装置如图2),写出红磷燃烧的文字或者符号表达式______________。兴趣小组用该方法测出的氧气含量12%,发现结果明显偏低,可能的原因是:(1)装置漏气;(2)___;(3)…
(结论与反思)多次实验证明红磷燃烧测定空气中氧气含量都明显低于21% ,通过查阅资料显示:当氧气的体积分数低于7%,红磷就要熄灭,无法将氧气耗尽,所以误差较大。
(实验探究1)已知铁生锈是与空气中的氧气和水发生化学反应的过程,生成一种暗红色的固体。小明根据铁生锈的原理,探究用铁能否准确测定空气中氧气的含量,于是进行了实验(装置如图3),通过7天测得的数据计算空气中氧气的含量为19.13%。
(交流与反思)实验结束后能观察到的现象是铁丝表面有暗红色物质生成、试管内液面_______(填“上升”“下降”或“不变”)。
与用红磷燃烧的方法相比,用铁丝生锈的方法测定空气中氧气的含量的主要优点是:___________________________。
(实验探究2)为了加快反应速率,小明通过查阅资料,利用铁粉、炭粉、氯化钠、蒸馏水等物质又进行了实验(装置如图4),8分钟后测得的数据如表:
实验前的体积 | 实验后的体积 | |
集气瓶内空气 | 烧杯内蒸馏水 | 烧杯内剩余蒸馏水 |
130mL | 90.0mL | 63.6mL |
请计算出空气中氧气含量_____________(计算结果保留一位小数)
(结论与反思)通过上述实验探究,利用铁粉比铁丝可快速地完成实验并减小实验误差,你认为可能的原因是_______(填序号);
A.相同条件下,铁粉与反应物间有更大的接触面积,能使反应更快速充分
B.两者是不同物质,铁粉的化学性质更活泼,更容易与氧气反应
实验中炭粉、氯化钠能明显加快反应速率,则它们在反应中所起的作用可能是______作用。
(拓展延伸)常温下铜能与氧气、水、二氧化碳反应而锈蚀,生成铜绿(Cu2(OH)2CO3),写出该反应的文字或符号表达式_______,但若缺少其中一种物质则铜不会锈蚀。若将图3装置中的粗铁丝换成足量的铜丝进行实验,请判断能否比较准确地测定空气中氧气的含量,并说明理由_________。
【答案】BCD1/5或21%P+O2![]() P2O5红磷太少等均可上升装置内残留的氧气少,实验更精确或减少污染,减少误差等(合理均可)20.3%A催化Cu+CO2+O2+H2O
P2O5红磷太少等均可上升装置内残留的氧气少,实验更精确或减少污染,减少误差等(合理均可)20.3%A催化Cu+CO2+O2+H2O![]() Cu2(OH)2CO3不能,因为空气中二氧化碳只含0.03%,所以不能把氧气耗尽
Cu2(OH)2CO3不能,因为空气中二氧化碳只含0.03%,所以不能把氧气耗尽
【解析】
经典赏析:教材中介绍了拉瓦锡用定量的方法研究了空气的成分(实验装置如图1),该实验中选择使用汞的优点有在汞槽中起到液封作用;生成的化合物加热分解又能得到汞和氧气;能将密闭装置内空气中的氧气集合耗尽;
通过实验拉瓦锡得出了空气由氧气和氮气组成,其中氧气约占空气总体积的![]() 的结论
的结论
实验回顾:磷和氧气在点燃的条件下生成五氧化二磷,反应的符号表达式为:P+O2![]() P2O5;实验中装置漏气;所取的红磷不足(或实验前没有夹弹簧夹、实验装置可能未冷却就打开弹簧夹等)都会导致测量的结果偏小;
P2O5;实验中装置漏气;所取的红磷不足(或实验前没有夹弹簧夹、实验装置可能未冷却就打开弹簧夹等)都会导致测量的结果偏小;
交流与反思:铁丝在水、氧气的条件下很容易生锈,导致装置内压强变小,液面上升;铁丝在水、氧气的条件下很容易生锈,与用红磷燃烧的方法相比,用铁丝生锈的方法测定的主要优点及原因:装置内残留的氧气更少,实验结果更准确;
实验探究2:烧杯内蒸馏水减少的体积为氧气的体积=90mL-63.6mL=26.4mL,空气中氧气含量=![]() ≈20.3%;
≈20.3%;
结论与反思:通过上述实验探究,选择铁粉进行实验,铁粉与反应物间有更大的接触面积可较为快速地完成实验并减小实验误差;实验中炭粉、氯化钠能明显加快反应速率,则它们在反应中所起的作用可能是催化作用;
拓展延伸:铜与空气中氧气、水、二氧化碳反应生成铜绿,该反应的文字或符号表达式:Cu+CO2+O2+H2O![]() Cu2(OH)2CO3;若将图3装置中的粗铁丝换成足量的铜丝进行实验,不能比较准确地测定空气中氧气的含量,因为空气中二氧化碳含量约只有0.03%,铜不能将装置中的氧气几乎耗尽。
Cu2(OH)2CO3;若将图3装置中的粗铁丝换成足量的铜丝进行实验,不能比较准确地测定空气中氧气的含量,因为空气中二氧化碳含量约只有0.03%,铜不能将装置中的氧气几乎耗尽。

【题目】分析处理图表中的信息是学习化学的一种重要方法,运用溶解度表与溶解度曲线回答下列问题:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
NH4Cl溶解度/g | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
NaCl溶解度/g | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
(1)氯化钠的溶解度曲线是 _________(填“甲”或“乙”)。
(2)20℃时,将40g NH4Cl加入100g的水中,充分搅拌后得到的是______溶液(填“饱和”或“不饱和”),将上述溶液升温到30℃,该溶液的溶质质量分数为_______(只列计算式,不需要计算结果)。
(3)如下图,t1℃时,将两种物质的饱和溶液各100g,分别恒温蒸发5g水,析出晶体最多的是______(填“甲”或“乙”)。

(4)计算配制50g质量分数为3%的NaCl溶液所需质量分数为6%的NaCl溶液的体积,需要用到的数据是_____________(填字母)。
A.3%的NaCl溶液的密度 B.水的密度 C.6%的NaCl溶液的密度
【题目】钢铁是重要的金属材料,在工农业生产和生活中应用非常广泛。
Ⅰ.铁的冶炼
工业炼铁的原理是高温下用CO作还原剂,将铁从氧化物中还原出来。请回答下列问题:
(1)写出以赤铁矿为原料,在高温下炼铁的化学方程式:___________________________;
(2)实验探究炼铁原理
某化学兴趣小组在实验室中模拟工业炼铁的原理,并探究CO与Fe2O3反应后的产物。
通过查阅资料知道:①草酸(H2C2O4)固体与浓硫酸混合加热会产生一氧化碳,反应方程式为:H2C2O4 ![]() CO↑+ CO2↑+ H2O。
CO↑+ CO2↑+ H2O。
②NaOH溶液可以吸收二氧化碳,反应方程式为:2NaOH+CO2=Na2CO3+H2O
③常温下,Ca(OH)2微溶于水;于是他设计了下图的实验装置,结合装置回答下列问题:
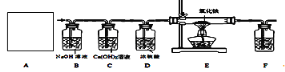
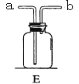
(1)图A是用固体草酸和浓硫酸制取CO的反应装置,你认为应选择下图中的_________(填装置编号);
(2)图中装置C、D的作用分别是 ____________、_______________;
(3)为了证明产物中有二氧化碳,装置F中的试剂应该是少量的_____________(填试剂名称),反应的化学方程式为 ______________________;
(4)该装置设计有一个明显缺陷,你认为是______________________________。
(5)实验时准确称取一定质量纯净的Fe2O3固体按上图进行实验,当E中固体全部变黑后,继续通入CO直到玻璃管冷却。将得到黑色的固体加入到足量的稀盐酸,发现固体全部溶解,但无气泡产生。
查阅资料:a. 铁的氧化物在足量的稀盐酸中均能全部溶解。
b. Fe2O3与CO反应的固体生成物可能情况如下:
![]()
根据“无气泡”猜想,黑色粉末可能是:① Fe3O4 ;②_________ ③ ____________。
(6)定量分析 用电子天平称量得部分数据如下:
玻璃管质量 | 玻璃管及其中固体的质量 | 装置F及其中物质的总质量 | |
反应前 | 28.20 g | 33.00 g | 300.0 g |
反应后 | 32.84 g | 300.4 g |
根据上述数据,纯净的Fe2O3固体质量为_____________g,请选择有效的数据,推断出反应后黑色固体的成分(写出计算过程)__________________________。
根据推断结果,写出该实验中玻璃管内发生的化学反应方程式:__________________________。