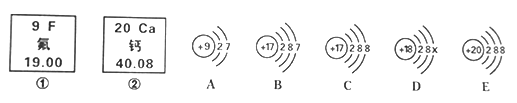
题目内容
【题目】某化学小组向AgNO3和Al(NO3)3的混合溶液加入一定量的铜粉和锌粉,充分反应后过滤,得到溶液甲和固体乙,如图所示,回答下列问题。

(1)固体乙中一定含有____,可能含有________。
(2)若溶液甲为蓝色,则溶液甲中一定含有的金属离子为____(填离子符号);
(3)若向固体乙上滴加盐酸有气泡产生,则溶液甲中一定没有________。
【答案】 Ag Cu或Cu、Zn Al3+ Zn2+ Cu2+ Ag+ Cu2+或AgNO3 Cu(NO3)2
【解析】一定量AgNO3和Al(NO3)3的混合溶液加入铜粉和锌粉,充分反应后过滤,因为铝的活动性最强所以不会被置换,锌的活动性大于铜和银,所以一旦反应就会进入溶液,因此溶液甲中一定含有Al(NO3)3和Zn(NO3)2;因为银的活动性最弱,所以银一定会被置换,因此固体乙中一定含有Ag,可能含有铜或Cu和Zn;若溶液甲是蓝色,说明溶液中还有铜离子,则溶液甲一定含Al(NO3)3、Zn(NO3)2和Cu(NO3)2,溶液甲中一定含有的金属离子为:Al3+ Zn2+ Cu2+;向固体乙滴加稀盐酸有气泡产生,说明还有锌剩余,因此铜和银都会被置换,因此则溶液甲中一定没有AgNO3和Cu(NO3)2。

【题目】钢铁是重要的金属材料,在工农业生产和生活中应用非常广泛。
Ⅰ.铁的冶炼
工业炼铁的原理是高温下用CO作还原剂,将铁从氧化物中还原出来。请回答下列问题:
(1)写出以赤铁矿为原料,在高温下炼铁的化学方程式:___________________________;
(2)实验探究炼铁原理
某化学兴趣小组在实验室中模拟工业炼铁的原理,并探究CO与Fe2O3反应后的产物。
通过查阅资料知道:①草酸(H2C2O4)固体与浓硫酸混合加热会产生一氧化碳,反应方程式为:H2C2O4 ![]() CO↑+ CO2↑+ H2O。
CO↑+ CO2↑+ H2O。
②NaOH溶液可以吸收二氧化碳,反应方程式为:2NaOH+CO2=Na2CO3+H2O
③常温下,Ca(OH)2微溶于水;于是他设计了下图的实验装置,结合装置回答下列问题:
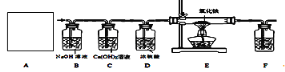
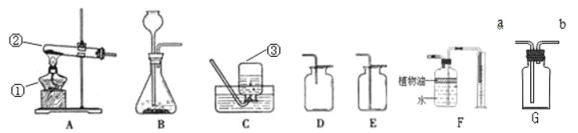
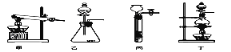
(1)图A是用固体草酸和浓硫酸制取CO的反应装置,你认为应选择下图中的_________(填装置编号);
(2)图中装置C、D的作用分别是 ____________、_______________;
(3)为了证明产物中有二氧化碳,装置F中的试剂应该是少量的_____________(填试剂名称),反应的化学方程式为 ______________________;
(4)该装置设计有一个明显缺陷,你认为是______________________________。
(5)实验时准确称取一定质量纯净的Fe2O3固体按上图进行实验,当E中固体全部变黑后,继续通入CO直到玻璃管冷却。将得到黑色的固体加入到足量的稀盐酸,发现固体全部溶解,但无气泡产生。
查阅资料:a. 铁的氧化物在足量的稀盐酸中均能全部溶解。
b. Fe2O3与CO反应的固体生成物可能情况如下:
![]()
根据“无气泡”猜想,黑色粉末可能是:① Fe3O4 ;②_________ ③ ____________。
(6)定量分析 用电子天平称量得部分数据如下:
玻璃管质量 | 玻璃管及其中固体的质量 | 装置F及其中物质的总质量 | |
反应前 | 28.20 g | 33.00 g | 300.0 g |
反应后 | 32.84 g | 300.4 g |
根据上述数据,纯净的Fe2O3固体质量为_____________g,请选择有效的数据,推断出反应后黑色固体的成分(写出计算过程)__________________________。
根据推断结果,写出该实验中玻璃管内发生的化学反应方程式:__________________________。