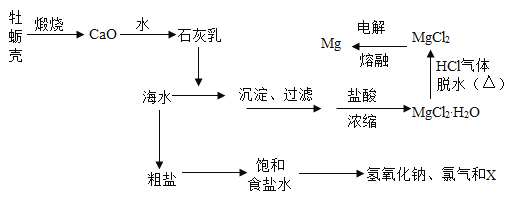
题目内容
【题目】实验室制取皓矾![]() ,晶体析出前的酸性饱和溶液中含有少量的
,晶体析出前的酸性饱和溶液中含有少量的![]() 、
、![]() 和
和![]() 等杂质离子,为了除去杂质,获得纯净的皓矾晶体,设计如下工艺流程:
等杂质离子,为了除去杂质,获得纯净的皓矾晶体,设计如下工艺流程:
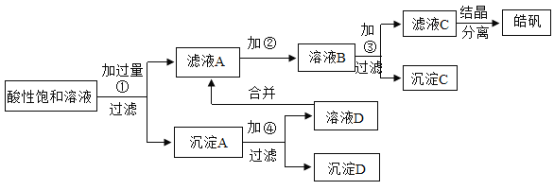
已知开始生成氢氧化物沉淀到沉淀完全的![]() 值范围分别为:
值范围分别为:![]() :2.7~3.7;
:2.7~3.7;![]() :7.6~9.6;
:7.6~9.6;![]() :5.7~8.0;
:5.7~8.0;
试回答下列有关的问题:
(1)加入的试剂①应是_____。
(2)加入的试剂②是供选择使用的氧化剂:高锰酸钾溶液、20%的过氧化氢![]() 、浓硝酸。应选用_____最好,其理由是_____。
、浓硝酸。应选用_____最好,其理由是_____。
(3)加入试剂③是_____,其目的是_____。
【答案】Zn 20%的过氧化氢 不引入新的杂质 氧化锌 调节溶液pH值
【解析】
(1)饱和酸性溶液中含有![]() 、
、![]() 和
和![]() ,要除去这些离子可以利用金属活动性来进行去除,由于制得皓矾中含有锌元素,所以可以加入锌,通过锌与三种离子反应,分别反应方程式如下:
,要除去这些离子可以利用金属活动性来进行去除,由于制得皓矾中含有锌元素,所以可以加入锌,通过锌与三种离子反应,分别反应方程式如下:![]() ,
,![]() ,
,![]() ,这样就可以除去铜,而此时其余离子都变为+2价的亚铁离子,然后通过氧化剂,将其变为+3价的铁离子,就可以通过调节pH来使其沉淀,达到分离的目的;
,这样就可以除去铜,而此时其余离子都变为+2价的亚铁离子,然后通过氧化剂,将其变为+3价的铁离子,就可以通过调节pH来使其沉淀,达到分离的目的;
故答案为:Zn。
(2)根据(1)中可知,加入②的氧化剂是将+2价的亚铁离子氧化成+3价的铁离子,所以加入氧化剂发生反应后,不应再引入杂质,高锰酸钾和浓硝酸作为氧化剂后,都可以生成新的杂质,只有双氧水参与反应后生成水,不会有新杂质出现,所以选择20%的过氧化氢作为氧化剂使用;
故答案为:20%的过氧化氢;不引入其它杂质。
(3)③中加入试剂主要调节pH值,使三价的铁离子形成沉淀,被过滤出来,而只要pH在2.7~3.7之间,就需要加入③来调节pH,其目的是将酸性溶液中的酸中和一部分,使pH达到2.7~3.7,以保证形成氢氧化铁沉淀;由于是制备![]() ,所以加入氧化锌即可,与过量的硫酸反应生成硫酸锌和水,消耗了酸,还不引入新的杂质;
,所以加入氧化锌即可,与过量的硫酸反应生成硫酸锌和水,消耗了酸,还不引入新的杂质;
故答案为:氧化锌;调节溶液pH值。

 导学全程练创优训练系列答案
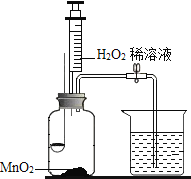
导学全程练创优训练系列答案【题目】用如图所示装置,在常温下,分别进行研究燃烧条件和研究氧气性质的实验。已知:白磷的着火点为40℃。
内容步骤 | (实验1)研究燃烧条件 | (实验2)研究氧气性质 |
Ⅰ | 烧杯中盛有80℃的热水,分别在燃烧匙和烧杯中导管口放置一小块白磷,塞紧瓶塞 | 烧杯中盛有NaOH溶液(能吸收CO2),燃烧匙中放入木炭 点燃木炭后,迅速将燃烧匙伸入瓶中,塞紧瓶塞 |
Ⅱ | 推入适量H2O2溶液 | 推入适量H2O2溶液 |
(1)H2O2稀溶液与MnO2接触时发生反应的化学方程式为____________________。
(2)实验1中,推入H2O2溶液前,燃烧匙和水中的白磷均不燃烧,原因分别是________、_________;推入H2O2溶液打开止水夹,观察到烧杯中的现象是_________。
(3)实验2中,推入H2O2溶液后,观察到木炭燃烧得更剧烈,由此得出氧气的性质是__________;木炭熄灭后冷却一段时间,烧杯中的部分溶液流入集气瓶。该实验中,集气瓶内压强的变化过程是___________。
(4)下面是一些常用的灭火方法的事例:
①熄灭酒精灯时,用灯帽盖灭;②熄灭燃气灶火焰时,关闭阀门;③油锅着火时,用锅盖盖灭;④森林着火时,将大火蔓延线路前的一片树木砍掉;⑤房屋着火时,用高压水枪灭火。请你从灭火原理角度,选择一种分类标准进行分类:分类标准________,包括事例_________(填序号)。
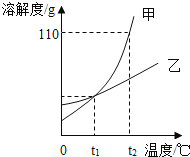
【题目】甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是

A.将甲、乙的饱和溶液从t2℃分别降温到t1℃,析出晶体的质量甲一定大于乙 |
B.t1℃时甲、乙的饱和溶液中溶质质量分数相等 |
C.t2℃时将40g甲溶于100g水中,形成饱和溶液 |
D.将M点的甲溶液变成饱和溶液常采取的方法是__________________________。 |