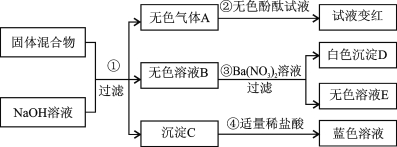
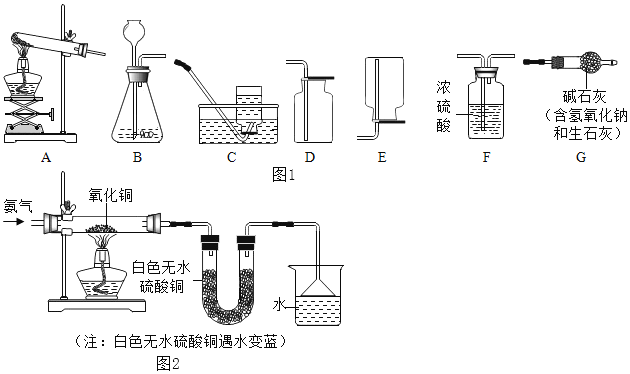
题目内容
【题目】为了测定某黄铜样品中铜的质量分数,某化学小组进行了如下实验:
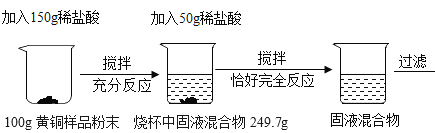
请回答下列问题:
(1)上述实验过程中发生反应的化学方程式为_____;
(2)根据已知条件列出求解第一次所加的稀盐酸中溶质质量(x)的比例式_____;
(3)此黄铜样品中铜的质量分数为_____;
(4)用 36.5%的浓盐酸配制 200g 上述稀盐酸,所需浓盐酸的质量为_____g;
(5)若将反应后的滤液蒸发掉 12.6g 水,所得不饱和溶液中溶质的质量分数为_____;
(6)欲将黄铜样品中的铜转化为铜盐,可将过滤后所得固体洗涤、烘干,然后在空气中加热,充分反应,可得到氧化铜的质量是_____g,再经过某些反应及操作就得到了所 需铜盐。
【答案】Zn+2HCl═ZnCl2+H2↑ ![]() 87% 40 13.6% 108.75
87% 40 13.6% 108.75
【解析】
(1)黄铜是铜和锌的合金,锌和盐酸反应生成氯化锌和氢气,化学方程式为:Zn+2HCl═ZnCl2+H2↑;故填:Zn+2HCl═ZnCl2+H2↑;
(2)第一次所加的稀盐酸生成氢气的质量为:100g+150g-249.7g=0.3g
设第一次所加的稀盐酸中溶质质量为x
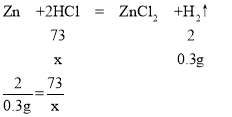
x=10.95g
故填:![]() ;
;
(3)所用稀盐酸的质量分数为:![]()
设此黄铜样品中锌的质量为y,生成氯化锌的质量为z,生成氢气的质量为w
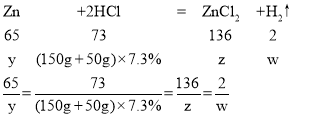
y=13g z=27.2g w=0.4g
此黄铜样品中铜的质量分数为:![]()
答:此黄铜样品中铜的质量分数为87%。
故填:87%;
(4)设所需36.5%浓盐酸的质量为a,则
a×36.5%=200g×7.3%
a=40g
故填:40;
(5)根据第三问求得生成氯化锌的质量为27.2g,若将反应后的滤液蒸发掉12.6g 水,所得不饱和溶液中溶质的质量分数为:![]() ;
;
故填:13.6%;
(6)设生成氧化铜的质量为b
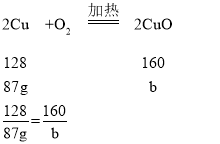
b=108.75g
答:可得到氧化铜的质量是108.75g。
故填:108.75。