题目内容
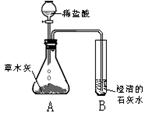
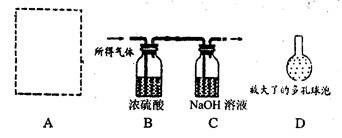
(9分)查阅资料可知:浓硫酸能吸水,且不与CO2反应:CO2能与NaOH溶液反应生成碳酸钠和水。某同学为了测定某石灰石矿样中碳酸钙的质量分数,按下列过程进行实验:用过量稀盐酸溶解矿样(杂质不与盐酸反应)→用浓硫酸干燥所得气体→用过量NaOH溶液吸收CO2→根据NaOH溶液的增重计算矿样中碳酸钙的质量分数,实验装置如下图所示:
(1)其中A为溶解矿样的实验装置,若已准备了分液漏斗、双孔橡胶塞、试管,为完成溶解并将产生的气体通入B中至少还需要的实验仪器是 ▲ 。
(2)在装置气密性良好的情况下,某同学将经过准确称量的矿样加入试管后,通过分液漏斗加入过量稀盐酸进行实验。当A中产生大量气泡时,发现B中没有气泡,为准确测定该石灰石矿样中碳酸钙的质量分数,该同学应该 ▲ 。
(3)下列情况一定不会使实验结果产生偏差的是 ▲ (填序号):
A.实验开始前用纯净的氮气除去实验系统内残留的空气
B.让气体快速通过盛有浓硫酸和NaOH溶液的洗气瓶
C.装置C右端导管口连接一个能吸收CO2和H2O的装置
D.实验结束时,整个实验系统内保留少量二氧化碳气体
E.用经过准确称量的呈块状的石灰石试样直接进行实验
(4)将插入NaOH溶液下端的导管改成多孔球泡(如图中的D),能让NaOH溶液更好地吸收二氧化碳,其理由是 ▲ :
(5)某次实验时,称取了10.0g矿样,经正确操作后,测得C装置在实验前后的质量增加了3.6g,则该次实验时测得该矿样中碳酸钙的质量分数为多少?(请写出计算步骤,精确到小数点后一位)

(1)其中A为溶解矿样的实验装置,若已准备了分液漏斗、双孔橡胶塞、试管,为完成溶解并将产生的气体通入B中至少还需要的实验仪器是 ▲ 。
(2)在装置气密性良好的情况下,某同学将经过准确称量的矿样加入试管后,通过分液漏斗加入过量稀盐酸进行实验。当A中产生大量气泡时,发现B中没有气泡,为准确测定该石灰石矿样中碳酸钙的质量分数,该同学应该 ▲ 。
(3)下列情况一定不会使实验结果产生偏差的是 ▲ (填序号):
A.实验开始前用纯净的氮气除去实验系统内残留的空气
B.让气体快速通过盛有浓硫酸和NaOH溶液的洗气瓶
C.装置C右端导管口连接一个能吸收CO2和H2O的装置
D.实验结束时,整个实验系统内保留少量二氧化碳气体
E.用经过准确称量的呈块状的石灰石试样直接进行实验
(4)将插入NaOH溶液下端的导管改成多孔球泡(如图中的D),能让NaOH溶液更好地吸收二氧化碳,其理由是 ▲ :
(5)某次实验时,称取了10.0g矿样,经正确操作后,测得C装置在实验前后的质量增加了3.6g,则该次实验时测得该矿样中碳酸钙的质量分数为多少?(请写出计算步骤,精确到小数点后一位)

本题考查的是实验探究物质的组成成分以及含量,碳酸钠、碳酸氢钠与碳酸钙,根据化学反应方程式的计算。
(1)根据实验室中制取二氧化碳的反应装置来进行解答,在实验室中制取二氧化碳气体不需要加热,所以根据所给的仪器可以知道还缺少导管和铁架台;
(2)当A中产生大量气泡时,发现B中没有气泡,可能是装置的气密性不好,所以为准确测定该石灰石矿样中碳酸钙的质量分数,该同学应该检查装置,然后重新称量矿样,重做实验;
(3)A、氮气不能和氢氧化钠反应,所以不会影响二氧化碳的吸收,故不会影响实验结果;
B、让气体快速通过盛有浓硫酸和NaOH溶液的洗气瓶,会影响二氧化碳的干燥和吸收从而影响实验结果;
C、装置C右端导管口连接一个能吸收CO2和H2O的装置,没有接触到氢氧化钠溶液,且能吸收空气中的水和二氧化碳,避免干扰,所以不能影响实验结果;
D、实验结束时,整个实验系统内保留少量二氧化碳气体,说明二氧化碳没有完全被吸收,所以会影响实验结果;
E、物质间的接触面积越大,反应越充分,所以用块状的石灰石,可能会导致一部分碳酸钙不能完全反应,故会影响实验结果;故选AC;
(4)物质间的接触面积越大,反应越充分,所以将插入NaOH溶液下端的导管改成多孔球泡,能让NaOH溶液更好地吸收二氧化碳;
(5)氢氧化钠溶液溶液增加了3.6g,即生成二氧化碳气体的质量为3.6g;
设石灰石样品中碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 3.6g
100/44 ="x/3.6g"
解得:x=8.18g
所以该矿样中碳酸钙的质量分数为:8.18g/10g ×100%=81.8%
答:该矿样中碳酸钙的质量分数为81.8%。
(1)根据实验室中制取二氧化碳的反应装置来进行解答,在实验室中制取二氧化碳气体不需要加热,所以根据所给的仪器可以知道还缺少导管和铁架台;
(2)当A中产生大量气泡时,发现B中没有气泡,可能是装置的气密性不好,所以为准确测定该石灰石矿样中碳酸钙的质量分数,该同学应该检查装置,然后重新称量矿样,重做实验;
(3)A、氮气不能和氢氧化钠反应,所以不会影响二氧化碳的吸收,故不会影响实验结果;
B、让气体快速通过盛有浓硫酸和NaOH溶液的洗气瓶,会影响二氧化碳的干燥和吸收从而影响实验结果;
C、装置C右端导管口连接一个能吸收CO2和H2O的装置,没有接触到氢氧化钠溶液,且能吸收空气中的水和二氧化碳,避免干扰,所以不能影响实验结果;
D、实验结束时,整个实验系统内保留少量二氧化碳气体,说明二氧化碳没有完全被吸收,所以会影响实验结果;
E、物质间的接触面积越大,反应越充分,所以用块状的石灰石,可能会导致一部分碳酸钙不能完全反应,故会影响实验结果;故选AC;
(4)物质间的接触面积越大,反应越充分,所以将插入NaOH溶液下端的导管改成多孔球泡,能让NaOH溶液更好地吸收二氧化碳;
(5)氢氧化钠溶液溶液增加了3.6g,即生成二氧化碳气体的质量为3.6g;
设石灰石样品中碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 3.6g
100/44 ="x/3.6g"
解得:x=8.18g
所以该矿样中碳酸钙的质量分数为:8.18g/10g ×100%=81.8%
答:该矿样中碳酸钙的质量分数为81.8%。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目