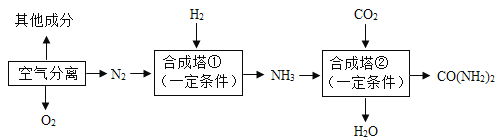
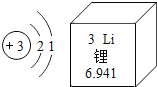
题目内容
【题目】某锥形瓶盛有盐酸和氯化铜的混合溶液100g,向其中逐滴加入溶质质量分数为10%的氢氧化钠溶液,锥形瓶内溶液质量与滴入的氢氧化钠溶液的质量的变化关系如图所示。请计算:
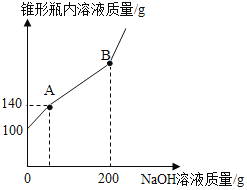
(1)A点之前都是氢氧化钠与 _______ 反应 ;
(2)反应至A点时,消耗氢氧化钠溶液的质量为_____g ;
(3)计算反应至B点时锥形瓶内所得溶液的溶质质量分数为_____?(计算结果保留至0.1%)
【答案】盐酸 40g 10.4%
【解析】
(1)向混合溶液中逐滴加入氢氧化钠溶液,根据“优先反应”原则,氢氧化钠先与稀盐酸反应生成氯化钠和水,待稀盐酸完全反应后,氢氧化钠再与氯化铜反应生成氢氧化铜和氯化钠,故A点之前都是氢氧化钠与盐酸反应;
(2)氢氧化钠与稀盐酸反应生成氯化钠和水,溶液增加的质量,就是加入的氢氧化钠的质量,反应至A点时,溶液增加40g,消耗氢氧化钠溶液的质量为40g;
(3)解:设氢氧化钠与盐酸反应生成氯化钠的质量为x

![]() x=5.85g
x=5.85g
设氢氧化钠与氯化铜反应生成氯化钠的质量为y,生成氢氧化铜的质量为z

![]() y=23.4g
y=23.4g
![]() z=19.6g
z=19.6g
反应至B点时锥形瓶内所得溶液的溶质质量分数为:
![]() 。
。
答:反应至B点时锥形瓶内所得溶液的溶质质量分数为10.4%。

【题目】依据下列实验数据和溶解度曲线回答以下小题。
① | ② | ③ | ④ | |
温度 | 10℃ | 10℃ | 30℃ | 30℃ |
固体种类 | KNO3 | NaCl | KNO3 | NaCl |
固体质量 | 30g | 30g | 40g | 40g |
水的质量 | 100g | 100g | 100g | 100g |
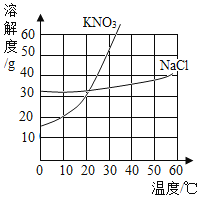
【1】①~④所得的溶液中,属于不饱和溶液的是( )
A.①和②B.②和③C.③和④D.①和④
【2】下列说法中,正确的是( )
A.溶质质量:①=②B.溶液质量:②>③
C.溶质与溶剂质量比:①=③D.溶质质量分数:③>④
【题目】实验室有一瓶久置的氢氧化钠固体,李璧凝同学想了解其变质情况,称取 9.3g 干燥的样品,加水使其完全溶解,然后向其中逐滴滴加氢氧化钙溶液,所得沉淀质量与加入氢氧化钙溶液质量关系如下表所示:
实验编号 | ① | ② | ③ | ④ |
氢氧化钙溶液质量/g | 100 | 200 | 300 | 400 |
沉淀质量/g | 2 | m | 5 | 5 |
(1)实验②中 m 的数值为_________________。
(2)计算该氢氧化钠固体中碳酸钠的质量分数____________。(写出计算过程,结果精确到 0.1%)
(3)请在下图中画出生成沉淀质量随加入氢氧化钙溶液质量变化的曲线图,并标出图中的必要数据______________。
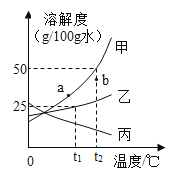
【题目】分析处理图表中的信息是学习化学的一种重要方法。运用溶解度表与溶解度曲线回答问题:
温度/°c | 0 | 10 | 20 | 30 | 40 | 50 |
NH4C1溶解度/g | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
NaCl溶解度/g | 35.7 | 35.8 | 36.0 | 36,3 | 36. 6 | 37.0 |
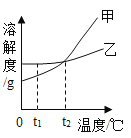
(1)氯化钠的溶解度曲线是_____(填"甲”或“乙”)。
(2)20℃时,将40 gNH4Cl加入100 g的水中,充分搅拌后得到的是______(填“饱和”或“不饱和”)溶液。将上述溶液升温到30 °C,该溶液的溶质质量分数为__
(3)t1 °C时,将甲、乙两种物质的饱和溶液各100 g分别恒温蒸发5 g水,析出晶体最多的是_____(填“甲”或'乙”)。
(4)计算配制50 g质量分数为3%的NaCl溶液所需质量分数为6%的NaCl溶液的体积,需要用到的数据是_____(填字母)。
A 3%的NaCl溶液的密度 B 水的密度 C 6%的NaCl溶液的密度