��Ŀ����
��ѧ��ȤС�����÷��ռ������Na2CO3��NaCl��MgCl2��CaCl2�ȣ���Na2CO3��10H2O��
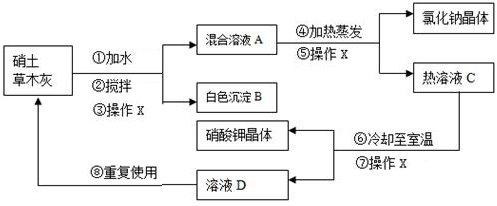
����ȡ���̡�

��������ϡ���Na2CO3+H2O+CO2��2NaHCO3
 ��2NaHCO3 Na2CO3+H2O+CO2��
��2NaHCO3 Na2CO3+H2O+CO2��
����NaHCO3��Һ�м���BaCl2��Һ���ɷ������·�Ӧ��
2NaHCO3+BaCl2��BaCO3��+2NaCl+ H2O+CO2��
��̼���Ƶı�����Һ�ڲ�ͬ�¶��������ľ�������ͼ��ʾ��
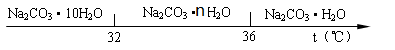
���������ۡ�
��1��������Ҫ�ɷ�ΪMg��OH��2�� ������Mg��OH��2�Ļ�ѧ����ʽ ��
��2����������ʹ�õIJ��������У��ձ��� �Ͳ�������
��3��ȡ������ҺB������BaCl2��Һ����ֻ�ϣ����۲쵽 ������������ҺB�к�NaHCO3��
��4���ᾧ����ʱ���¶������ �档
��5����ĸҺ������������������·��ѭ��ʹ�ã�ԭ���� ��ѡ����ţ���
�١�ĸҺ������Na2CO3 �� ��ĸҺ�����ѭ����NaCl��������
�����ȷ����
��6��ȡ�����Ĵֲ�Ʒ����ˮ�ܽ⣬������ ��ѡȡ������ţ���ͬ������ֽ��裬�ټ����� ��������֤�����в���NaCl��
��AgNO3��Һ ��ϡ���� ��ϡ����
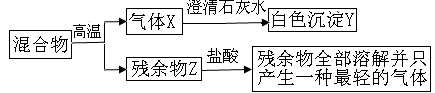
��7����ȤС��ͬѧȡ32.8g����ֲ�Ʒ������ͼ��ʾװ�ã��г�����ʡ�ԣ�����ʵ��

��������1��Na2CO3?10H2O������32�棬��ʼ�ֽ�ʧˮ����ּ��ȿ�����ȫʧˮ��
NaHCO350��ʱ��ʼ�ֽ⣬270����ȫ�ֽ⣬Na2CO3���Ȳ��ֽ�
��������2��Ba(OH)2��Һ������CO2��Ba(OH)2+CO2=BaCO3��+H2O
��ʵ��ǰ��Ҫ ����װ��ֲ�Ʒ��װ��A�������� ��
�ڴֲ�Ʒ������270�棬�� ����װ�ñ�ż�������֪�ֲ�Ʒ�к� ��
����ȡ���̡�

��������ϡ���Na2CO3+H2O+CO2��2NaHCO3
 ��2NaHCO3 Na2CO3+H2O+CO2��
��2NaHCO3 Na2CO3+H2O+CO2������NaHCO3��Һ�м���BaCl2��Һ���ɷ������·�Ӧ��
2NaHCO3+BaCl2��BaCO3��+2NaCl+ H2O+CO2��
��̼���Ƶı�����Һ�ڲ�ͬ�¶��������ľ�������ͼ��ʾ��
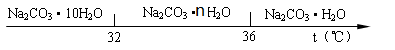
���������ۡ�
��1��������Ҫ�ɷ�ΪMg��OH��2�� ������Mg��OH��2�Ļ�ѧ����ʽ ��
��2����������ʹ�õIJ��������У��ձ��� �Ͳ�������
��3��ȡ������ҺB������BaCl2��Һ����ֻ�ϣ����۲쵽 ������������ҺB�к�NaHCO3��
��4���ᾧ����ʱ���¶������ �档
��5����ĸҺ������������������·��ѭ��ʹ�ã�ԭ���� ��ѡ����ţ���
�١�ĸҺ������Na2CO3 �� ��ĸҺ�����ѭ����NaCl��������
�����ȷ����
��6��ȡ�����Ĵֲ�Ʒ����ˮ�ܽ⣬������ ��ѡȡ������ţ���ͬ������ֽ��裬�ټ����� ��������֤�����в���NaCl��
��AgNO3��Һ ��ϡ���� ��ϡ����
��7����ȤС��ͬѧȡ32.8g����ֲ�Ʒ������ͼ��ʾװ�ã��г�����ʡ�ԣ�����ʵ��

��������1��Na2CO3?10H2O������32�棬��ʼ�ֽ�ʧˮ����ּ��ȿ�����ȫʧˮ��
NaHCO350��ʱ��ʼ�ֽ⣬270����ȫ�ֽ⣬Na2CO3���Ȳ��ֽ�
��������2��Ba(OH)2��Һ������CO2��Ba(OH)2+CO2=BaCO3��+H2O
��ʵ��ǰ��Ҫ ����װ��ֲ�Ʒ��װ��A�������� ��
�ڴֲ�Ʒ������270�棬�� ����װ�ñ�ż�������֪�ֲ�Ʒ�к� ��
��1�� CaCO3��2NaOH+MgCl2==Mg(OH)2��+2NaCl ����2��©������3���������ݣ���4��32��
��5���ڣ���6���ۡ��٣���7���ټ��װ�������ԣ� ���տ����еĶ�����̼��ˮ������
��E�в�����ɫ������ >�� 4.2�� ��Na2CO3��7H2O
��5���ڣ���6���ۡ��٣���7���ټ��װ�������ԣ� ���տ����еĶ�����̼��ˮ������
��E�в�����ɫ������ >�� 4.2�� ��Na2CO3��7H2O
�����������1���ɷ��ռ�ijɷֿ�֪������Ҫ�ɷ�ΪMg��OH��2��CaCO3���������ƺ��Ȼ�þ����������þ�������Ȼ��ƣ���2�����˷��õ���������Һ���ʲ����������ʹ�õIJ��������У��ձ���©���Ͳ���������3�����������������Ͽ�֪̼���������Ȼ�����Ӧ�����ɶ�����̼���壬��̼���Ʋ��ܣ��������ݲ�����֤����ҺB�к�NaHCO3����4���ᾧ�õ�Na2CO3��10H2O��������������Ͽ�֪������32�澧���ֽ⣬�ʹ���ʱ���¶������32�棻��5����Ϊ̼���ƺ��Ȼ��ƾ�������ˮ���ᾧ�����Һ�к���̼���ƺ��Ȼ��ƣ�̼������Ŀ��ɷ֣��Ȼ��������ʣ����Ȼ��Ƶ��ܽ�����¶�Ӱ��С��Ũ�ȴ�ʱ������ᾧ������ʹ�õ��ľ��岻������ѡ�ڣ���6��֤��̼�������Ƿ��Ȼ��ƣ�Ӧ�ȼ������ϡ�����ų�̼���Ƶĸ��ţ��ټ�����������Һ����������ɫ������֤��û���Ȼ��ƣ���7����ʵ��ǰҪ�ȼ��װ�õ������ԣ�ȷ��װ�ò�©����ʹ�Ƶõ�����ȷ��ʵ����Ҫ�������ɶ�����̼��ˮ���������ʼ�ʯ���dz�ȥ�����еĶ�����̼��ˮ������ʹʵ������ȷ������Ϊ̼�������Ȳ��ֽ⡢Na2CO3��10H2O�ֽ����ˮ������̼�����Ʒֽ��ܲ���������̼��ˮ������Eװ���У�������̼�ܺ�����������Ӧ����̼�ᱵ������Eװ�ñ����֤���ֲ�Ʒ�к�̼�����ƣ�C.D���ص�m1��������Ӧ���ɵ�ˮ��������E���ص�m2��̼�����Ʒֽ����ɵĶ�����̼��̼�����Ʒֽ����ɵ�ˮ�Ͷ�����̼��������Ϊ9:22����m1��m2>9:22����m2=1.1g������̼�����Ʒֽ�Ļ�ѧ����ʽ���Լ����̼�����Ƶ�����Ϊ4.2g���������������4�Ϳ�֪����ʱ36��õ�����Na2CO3��nH2O��̼�����ƵĻ��������ݼ��ٵ������Ǿ������ɵ�ˮ�����������û�ѧ����ʽ���㼴�ɽ��.���岽�����£�
Na2CO3��10H2O��Na2CO3��nH2O+��10-n��H2O
286 18��10-n��
32.8g-4.2g=28.6g 32.8g-27.4g=5.4g
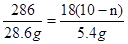 ���n=7 �ʸ�ʣ�������Na2CO3��7H2O��NaHCO3�Ļ����.
���n=7 �ʸ�ʣ�������Na2CO3��7H2O��NaHCO3�Ļ����.
��ϰ��ϵ�д�
 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�
�����Ŀ