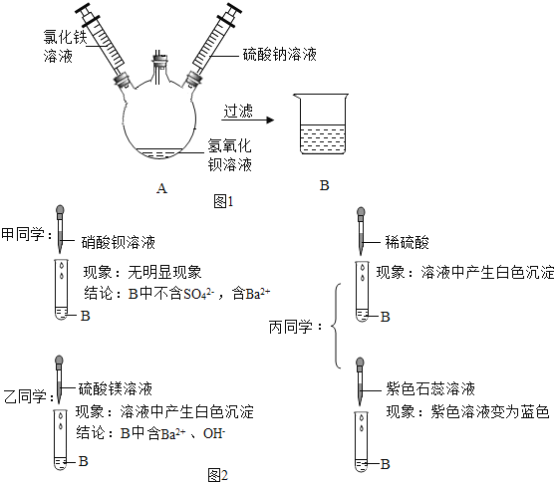
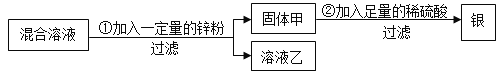
题目内容
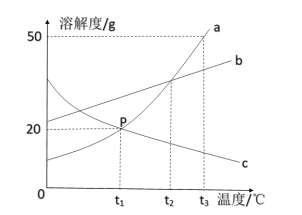
【题目】如图为A、B、C三种物质的溶解度曲线,据图回答:
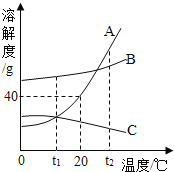
(1)当A中混有少B时,可用_____方法提纯A
(2)若将t1℃三种物质的饱和溶液分别升温到t2℃时,则三种溶液中溶质的质量分数由大到小的顺序是_____。
(3)20℃时,将30gA物质放入50g水中,所得溶液的溶质质量分数为_____(保留到0.1%)。
【答案】降温结晶 B>A>C 28.6%
【解析】
(1)如果溶解度受温度影响较大的物质从溶液中结晶析出的方法是冷却热饱和溶液,如果溶解度受温度影响不大的物质从溶液中结晶析出的方法是蒸发溶剂,由于A的溶解度随温度变化比较大,所以用降温结晶的方法;
(2)C的溶解度随温度升高而减小,AB的溶解度随温度升高而增大,若将t1℃三种物质的饱和溶液分别升温到t2℃时,AB溶解度增大,溶质的质量分数不变,C的溶解度减小,析出晶体,据饱和溶液中质量分数的计算式:![]() ,可知溶解度越大质量分数也就越大,而t1℃B的溶解度大于A的溶解度大于t2℃C的溶解度,则三种溶液中溶质的质量分数由大到小的顺序是B>A>C;。
,可知溶解度越大质量分数也就越大,而t1℃B的溶解度大于A的溶解度大于t2℃C的溶解度,则三种溶液中溶质的质量分数由大到小的顺序是B>A>C;。
(3)20℃时,A物质的溶解度是40g,说明100g水中最多溶解40g,即50g水中最多可溶解20g,所以将30gA物质放入50g水中所得溶液,所以所得溶液质量为20g+50g=70g,所得溶液的溶质质量分数为![]() 。
。

【题目】(5分)物质丙是重要的化工产品,在国民经济中占有重要地位。工业上用甲和乙合成丙。甲、乙、丙的微观示意图见下表。
物质 | 甲 | 乙 | 丙 |
|
微观示意图 |
|
|
|
(1)甲、乙、丙三种物质都是由(填“分子”、“原子”或“离子”) 构成的。
(2)甲、乙、丙中属于化合物的是(填序号) 。
(3)已知物质丙中氢元素的化合价为+1,则另一种元素的化合价为 。
(4)甲和乙合成丙的反应中,甲、乙、丙的微粒个数比为 。
(5)现有10 g 的甲和60 g 的乙混合反应制取丙,反应一段时间后,经测定剩余甲的质量为4 g,则剩余乙的质量为 g