��Ŀ����
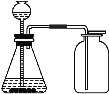
����Ŀ��ij��ѧ�С����һ��ʵ���н�������ͼ1��ʾʵ�飬����A��ע��һ�����Ȼ�����Һ����ע��һ������������Һ���˹����й۲쵽��������_____��С��ͬѧ����ɫ��ҺB������Ũ�����Ȥ�������˽�һ����̽�����
��������⣩B�к���������ʲô��
��ʵ��̽����
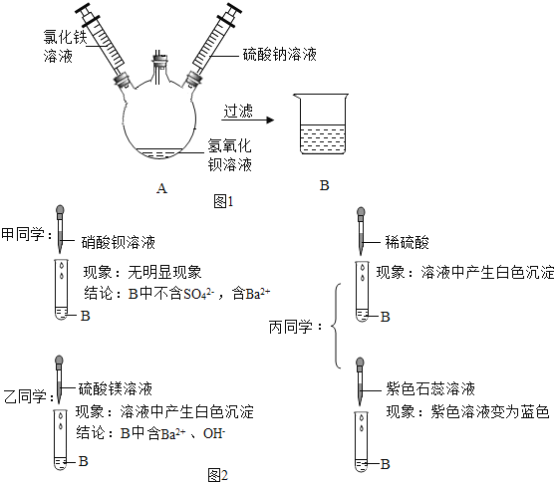
�����۽��������жϼ�ͬѧ�Ľ����Ƿ���ȷ����˵������_____����ͬѧ��Ϊ��ͬѧ�Ľ����Ǵ���ģ�ԭ����_____��
��ʵ����ۣ��������ʵ������ȷ��B�к���_____�������ӷ��ţ�������_____�������ӷ��ţ���
�������ܽᣩ�ɼס��ҡ���ͬѧʵ��Աȵó���ȷ����Һ�п��ܴ��ڵIJ�ͬ�����Ƿ���ڵķ����ǣ��ɸ��ݴ��������������Լ���Ӧ_____ȷ�������ڵ����ӣ�ͬʱ�Ʋ����ȷ�����ڵ������ܷ�Ӧ�����Ӳ����ڡ�
���𰸡��Ȳ������ɫ�������������ɫ���� ����ȷ����SO42-��Ba2+��û�У�Ҳ���������� ��Һ�к���Ba2+��OH-�е�һ�ֻ������֣���������þ��Һ����������� Ba2+��OH-��Na+��Cl- Fe3+��SO42- ������ͬ��������֮�������ɣ�
��������
�Ȼ�����Һ������������Һ��Ӧ�������������������Ȼ�������ע��һ������������Һ���Ȼ�������������Һ��Ӧ�������ᱵ�������Ȼ��ƣ���۲쵽�Ȳ������ɫ�������ٲ�����ɫ������
���۽���:
�Ȼ�����������������ͬʱ���ڣ���ҺB����ɫ��˵����Һ�в����Ȼ��������ܺ��������������Ȼ�������ͬѧ�μ����ᱵ��Һ�������Ա仯��˵����ɫ��ҺB�в�����������ӣ���Ҳ����ȷ���Ƿ����ӣ�Ҳ������ǡ����ȫ��Ӧ���ʼ�ͬѧ���۲���ȷ������ȷ���Ƿ���Ba2+��
����þ���뺬�����ӡ����������ӵ���Һ��Ӧ�������ᱵ��������þ�������μ�����þ��Һ��������ɫ����������ȷ���Ƿ����ӻ����������ӣ���Ϊֻ�������ӻ�ֻ������������Ҳ�������ͬ������
ʵ����ۣ�
�ɱ�ͬѧ��ʵ�飬�μ�ϡ���ᣬ������ɫ������˵����Һ�к��б����ӣ��μ���ɫʯ����Һ������ɫ��˵���������������ӡ��Ȼ�������������Һ��Ӧ�������ᱵ�������Ȼ��ƣ���B��Һһ�����������Ӻ������ӣ�����ȷ��B�к��б����ӡ����������ӡ������ӡ������ӣ�����ŷֱ���Ba2+��OH-��Na+��Cl-��
���ڱ���������������Ӳ��ܹ��棬��һ��������������ӣ���ҺB����ɫ��˵����Һ�в����Ȼ����������������ӣ������ӡ���������ӷ��ŷֱ���Fe3+��SO42-��

����Ŀ��ʵ����ϣ���ʦ֪��ij��ȤС����д����ᴿ��ʵ�飬���������������������ʵ�鱨�档
��ʵ�����ƣ����ε��ᴿ
���������ϣ�
��1�������к�����ɳ������������MgCl2��CaCl2��Na2SO4�����ʡ�
��2��Ba��OH��2��һ��������ˮ��ǿ�
����Ҫ������������Ͳ���ձ���©��������������ͷ�ιܡ��ƾ���
����Ҫ�Լ���������Ʒ��ϡ���ᡢBaCl2��Һ��NaOH��Һ��Na2CO3��Һ������ˮ
��ʵ����̣�
���輰Ŀ�� | ���̼�˵�� |
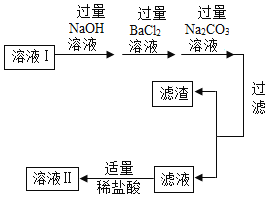
һ��ȥ�������е���ɳ | 1����ȡ������Ʒ10.0g��������ˮ����ܽ� 2������ȥ����ɳ����ҺI �������������о���Ҫʹ�õ��������������������÷ֱ��ǣ��ܽ�ʱ��_______������ʱ��_______�� |
����ȥ������ ������ | ����ҺI����ͼ����ͼ���д����� 1. ����������NaOH��Һʱ����������Ӧ�Ļ�ѧ����ʽ��_________�� 2. ���롰����̼������Һ��������Ӧ�ķ���ʽ��________�� 3. ���˺����õ������ɷ���_______�֡� 4. �ж���ϡ�����������ķ�����_______________��
|
������ò�Ʒ | ����Һ��ע��_______�����������ƣ��У������ᾧ���۲쵽_______��ֹͣ���ȣ������������ɡ�װ����ȫ��ȴ��ø���IJ�Ʒ9.4g�� |
�ġ����ݴ��� | �ô�����Ʒ���Ȼ��Ƶ�����������94% |
������뷴˼��
��1��ʵ��������Լ���װ�þ����������⣬��ʦȴָ������Ʒ���Ȼ��Ƶ�������������94%��ԭ����________________��
��2��С�����������������ֻ������������NaOH��Һ������������BaCl2��Һ���ļ���˳�Գ��ӽ��Ҳ�������Ӱ�죬��_______������ͬ����������ͬ������С���Ĺ۵㡣
����Ŀ�����г�ȥ���ʵķ����У�������ǣ�������
ѡ�� | ���� | ���� | �����ʵķ��� |
A | ϡ���� | ͭ | ���� |
B | ͭ�� | ���� | ����ϡ���ᡢ���� |
C |
|
| �������ۡ����� |
D | ������̼ | һ����̼ | ��ȼ |
A.AB.BC.CD.D